
| 1 | 2 | 3 | |
| 空白实验消耗硫酸铈标准溶液的体积(ml) | 0.75 | 0.50 | 0.80 |
| 0.25克样品消耗硫酸铈标准溶液的体积(ml) | 24.65 | 24.75 | 24.70 |
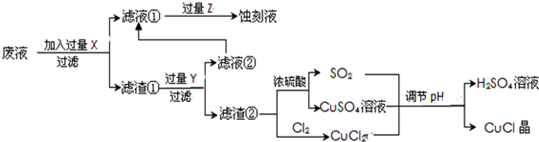
分析 要利用制作印刷电路的废液制备氯化亚铜,首先应制备并分离出铜,向工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)加入过量的铁粉,三价铁离子与铁粉反应转化为二价铁离子,铜离子与铁反应生成铜,然后过滤,滤渣为过量的铁和生成的铜,依据铜与铁活泼性,将滤渣溶于盐酸,铜与盐酸不反应,过滤得到滤渣即为铜,然后铜与浓硫酸反应生成硫酸铜和二氧化硫,铜与氯气反应生成氯化铜,硫酸铜、二氧化硫、氯化铜反应生成氯化亚铜;
(1)工业生产硫酸的方法为接触法制硫酸,氯碱工业的装置是离子交换膜电解槽;
(2)印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)加入铁,三价铁离子能够原铁反应生成二价铁离子,铜离子能够与铁反应生成铜;过滤后滤渣中含有铜和铁,依据铜和铁的活泼性,加入盐酸分离二者;
(3)依据图示可知:CuCl2、CuSO4、SO2、H2O反应生成H2SO4、CuCl,依据得失电子守恒配平方程式;
(4)抽滤或者减压过滤可以快速过滤,CuCl是一种白色粉末,微溶于水、不溶于乙醇及稀硫酸,乙醇洗涤可以减少CuCl的损失,生产过程中调节溶液的pH不能过大是防止其水解生成沉淀;
(5)依据图示可知:铜与浓硫酸反应生成硫酸铜、二氧化硫的物质的量之比为1:1,而产生CuCl的化学方程式中硫酸铜、二氧化硫物质的量之比恰好为:1:1;
(6)依据氯化亚铜具有还原性,易被氧化而变质,具有见光分解的性质解答;
(7)①玻璃珠在物质溶解过程中可以加速固体的溶解;
④依据方程式中各反应物量之间的关系计算CuCl的纯度.
解答 解:向工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)加入过量的铁粉,三价铁离子与铁粉反应转化为二价铁离子,铜离子与铁反应生成铜,然后过滤,滤渣为过量的铁和生成的铜,依据铜与铁活泼性,将滤渣溶于盐酸,铜与盐酸不反应,过滤得到滤渣即为铜,然后铜与浓硫酸反应生成硫酸铜和二氧化硫,铜与氯气反应生成氯化铜,硫酸铜、二氧化硫、氯化铜反应生成氯化亚铜;
(1)工业生产硫酸的方法名称是接触室,氯碱工业的装置是离子交换膜电解槽,
故答案为:接触室;离子交换膜电解槽;
(2)印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)加入铁,三价铁离子能够原铁反应生成二价铁离子,铜离子能够与铁反应生成铜,过滤后滤渣中含有铜和铁,加入盐酸,铁与盐酸反应生成氯化亚铁,铜与盐酸不反应,将铜分离出来,
故答案为:Fe;HCl;
(3)依据图示可知:CuCl2、CuSO4、SO2、H2O反应生成H2SO4、CuCl,产生CuCl的化学方程式依据得失电子守恒得到:CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2H2SO4,
故答案为:CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2H2SO4;
(4)生产中为了提高CuCl产品的质量,采用抽滤或者减压过滤法快速过滤,析出的CuCl晶体不用水而用无水乙醇洗涤的目的是减少CuCl的损失,生产过程中调节溶液的pH不能过大的原因是防止CuCl水解;
故答案为:抽滤或者减压过滤;减少产品CuCl的损失;防止CuCl的水解;
(5)依据图示可知:Cu+2 H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O反应中生成的CuSO4和 SO2为1:1,CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2 H2SO4反应中消耗CuSO4和SO2也为1﹕1,所以理论上不需要补充SO2气体,
故答案为:Cu+2 H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O反应中生成的CuSO4和 SO2为1:1,CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2 H2SO4反应中消耗CuSO4和SO2也为1﹕1,所以理论上不需要补充SO2气体;
(6)氯化亚铜具有还原性,易被氧化而变质,具有见光分解,所以生产中应防止CuCl的氧化和见光分解,减少产品CuCl的损失,
故答案为:防止CuCl的氧化和见光分解;
(7)①玻璃珠在物质溶解过程中可以加速固体的溶解,故答案为:加速固体的溶解;
④根据题目中所给数据及平行实验结果相差不能超过0.3%,滴定0.25g样品消耗硫酸铈标准溶液的平均体积是23.9ml,结合方程式可知:CuCl+FeCl3═CuCl2+FeCl2,CuCl的纯度为23.9×10-3L×0.1 mol•L-1×99.5g•mol-1/0.25g×100%=95%;
故答案为:95%.
点评 本题为工艺流程题,为高考热点和难点,设计物质的分离、物质的制备,明确物质的性质是解题关键,注意物质性质的理解应用,题目难度较大.


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 可简写为
可简写为 .现有某化合物W的分子结构可表示为:
.现有某化合物W的分子结构可表示为: .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属铝溶于NaOH溶液:Al+4OH-=[Al(OH)4]- | |
| B. | 向AlCl3溶液中加入足量氨水制备Al(OH)3:Al3++3OH-=Al(OH)3↓ | |
| C. | Na2SiO3溶液中通入过量CO2:CO2+H2O+SiO32-=H2SiO3↑+CO32- | |
| D. | 向Na[Al(OH)4]溶液中加入过量的盐酸:[Al(OH)4]-+4H+=Al3++4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 金属(粉末状)物质的量 | 酸的浓度及体积 | 反应温度/℃ |
| A | Mg 0.1mol | 0.1 6 mol•L-1硝酸10mL | 80 |
| B | Mg 0.1mol | 0.1 3 mol•L-1 盐酸10mL | 60 |
| C | Fe 0.1mol | 0.1 3 mol•L-1盐酸10mL | 60 |
| D | Mg 0.1mol | 0.1 3 mol•L-1硫酸10mL | 60 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com