
| A. | 氯化铵与氢氧化钙混合加热:NH4++OH-=NH3↑+H2O | |
| B. | 铁片溶于足量稀硝酸:Fe+2H+=Fe2++H2↑ | |
| C. | 盐酸与AgNO3溶液反应:HCl+Ag+=H++AgCl↓ | |
| D. | 稀氨水与稀盐酸混合:NH3?H2O+H+=NH4++H2O |
分析 A.氯化铵与氢氧化钙混合加热为固体之间的反应;
B.反应生成硝酸铁、NO和水;
C.氢离子实际不参加反应;
D.反应生成氯化铵和水.
解答 解:A.氯化铵与氢氧化钙混合加热为固体之间的反应,不能书写离子反应,故A错误;
B.铁片溶于足量稀硝酸的离子反应为Fe+NO3-+4H+=Fe3++NO↑+2H2O,故B错误;
C.盐酸与AgNO3溶液反应的离子反应为Cl-+Ag+=AgCl↓,故C错误;
D.稀氨水与稀盐酸混合的离子反应为NH3?H2O+H+=NH4++H2O,故D正确;
故选D.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.


 英才计划期末调研系列答案
英才计划期末调研系列答案 精英口算卡系列答案
精英口算卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 用加热分解的方法区分碳酸钠和碳酸氢钠两种固体 | |
| B. | 配置0.1000mol•L-1氢氧化钠溶液时,将液体转移到容量瓶中需用玻璃棒引流 | |
| C. | 检验NH4+时,往试样中加入NaOH溶液,微热,用湿润的蓝色石蕊试纸检验逸出的气体 | |
| D. | 分液时,分液漏斗的顶塞应打开或使塞上凹槽与壁上小孔对准 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
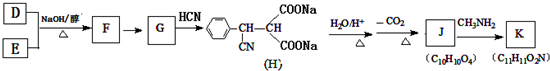
 ,则 D 的核磁共振氢谱有6种峰.F 中的无氧官能团为碳碳双键.
,则 D 的核磁共振氢谱有6种峰.F 中的无氧官能团为碳碳双键.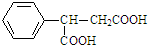 +CH3NH2$\stackrel{一定条件下}{→}$
+CH3NH2$\stackrel{一定条件下}{→}$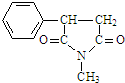 +2H2O.
+2H2O.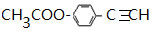 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 推广燃煤脱硫技术,减少SO2污染,同时把煤粉碎了再燃烧以提高煤的燃烧效率 | |
| B. | 开发新能源,如太阳能、风能等,减少对化石能源的依赖 | |
| C. | 推广煤的气化、液化技术,提供清洁燃料和化工原料 | |
| D. | 在汽车尾气处理器中使用新的催化剂,促使平衡2CO+2NO?2CO2+N2向正反应方向移动,减少污染物的排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
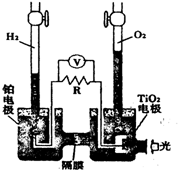 在光照射下可使水分解:2H2O $?_{光}^{TiO_{2}}$ 2H2↑+O2↑,该过程类似植物的光合作用.如图是光照射下TiO2分解水的装置示意图.下列叙述正确的是( )
在光照射下可使水分解:2H2O $?_{光}^{TiO_{2}}$ 2H2↑+O2↑,该过程类似植物的光合作用.如图是光照射下TiO2分解水的装置示意图.下列叙述正确的是( )| A. | 该装置可以将电能转化为化学能 | |
| B. | 铂电极上发生的反应为:2H++2e-=H2↑ | |
| C. | 该装置工作时,电流由TiO2电极经R流向铂电极 | |
| D. | 该装置工作时,TiO2电极附近溶液的pH变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 该溶液中 c(H2CO3)>c(CO32-) | |
| B. | 常温下,该溶液的pH>7 | |
| C. | 该溶液中阳离子总数小于阴离子总数 | |
| D. | 常温下,加水稀释时$\frac{c({H}^{+})•c(C{O}_{3}^{2-})}{c({H}_{2}C{O}_{3})}$不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
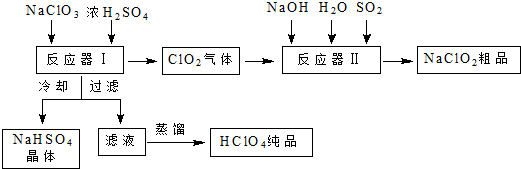
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com