
ŌŚ²»Ķ¬ÅØ¶Č£Øc£©”¢ĪĀ¶Č£ØT£©Ģõ¼žĻĀ£¬ÕįĢĒĖ®½āµÄĖ²Ź±ĖŁĀŹ£Øv£©ČēĻĀ±ķ£¬v µÄµ„Ī»ĪŖ(mmol”¤L£1”¤min£1)”£ĻĀĮŠÅŠ¶Ļ“ķĪóµÄŹĒ
c(mol”¤L£1) T / K | 0.600 | 0.500 | 0.400 | 0.300 |
318.2 | 3.60 | 3.00 | a | 1.80 |
328.2 | 9.00 | 7.50 | 6.00 | 4.50 |
b | 2.16 | 1.80 | 1.44 | 1.08 |
A£®318.2K£¬ÕįĢĒĘšŹ¼ÅضČĪŖ0.400 mol”¤L£1£¬10minŗóÕįĢĒÅضČĀŌ“óÓŚ 0.376 mol”¤L£1
0.376 mol”¤L£1
B£®b KŹ±£¬ČōÕįĢĒµÄÅضČĪŖ0.35 mol”¤L£1£¬Ōņv = 1.26 mmol”¤L£1”¤min£1[
C£®b < 318.2
D£®ČōĶ¬Ź±øı䷓ӦĪĀ¶ČŗĶÕįĢĒµÄÅØ¶Č£¬ŌņvæĻ¶Ø±ä»Æ
 ĆūŹ¦½šŹÖÖøĮģĻĪæĪŹ±ĻµĮŠ“š°ø
ĆūŹ¦½šŹÖÖøĮģĻĪæĪŹ±ĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2015-2016ѧğøŹĖąŹ”°×ŅųŹŠø߶žÉĻĘŚÖŠĪÄ»Æѧ¾ķ £Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
¹ŲÓŚĪ¬ÉśĖŲCµÄĖµ·ØÖŠ²»ÕżČ·µÄŹĒ£Ø £©
A£®Ņ×ČÜÓŚĖ®£¬Ė®ČÜŅŗĻŌĖįŠŌ B£®ŹÜČČŅ×±»Ńõ»Æ
C£®ŌŚĖ®ČÜŅŗÖŠČŻŅ×±»»¹Ō D£®ŠĀĻŹµÄĖ®¹ūŗĶŹß²ĖÖŠŗ¬ÓŠĪ¬ÉśĖŲC
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2016-2017ѧğÕć½Ź”ø߶žÉĻĘŚÖŠ»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ČēĶ¼×°ÖĆÖŠ£¬ÓŠČēĻĀŹµŃéĻÖĻó£ŗæŖŹ¼Ź±²åŌŚŠ”ŹŌ¹ÜÖŠµÄµ¼¹ÜÄŚµÄŅŗĆęĻĀ½µ£¬Ņ»¶ĪŹ±¼äŗóµ¼¹ÜÄŚµÄŅŗĆę»ŲÉż£¬ĀŌøßÓŚUŠĶ¹ÜÖŠµÄŅŗĆę”£ŅŌĻĀÓŠ¹Ų½āŹĶ²»ŗĻĄķµÄŹĒ
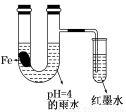
A£®ÉśĢśĘ¬ÖŠĖłŗ¬µÄĢ¼ÄÜŌö ĒæĢśµÄæ¹øÆŹ“ŠŌ
ĒæĢśµÄæ¹øÆŹ“ŠŌ
B£®ÓźĖ®ĖįŠŌ½ĻĒæ£¬ÉśĢśĘ¬æŖŹ¼·¢ÉśĪöĒāøÆŹ“
C£®µ¼¹ÜÄŚÄ«Ė®ŅŗĆę »ŲÉżŹ±£¬Õż¼«·“Ó¦Ź½£ŗO2£«2H2O£«4e”Ŗ==4OH£
»ŲÉżŹ±£¬Õż¼«·“Ó¦Ź½£ŗO2£«2H2O£«4e”Ŗ==4OH£
D£®Ėę×Å·“Ó¦µÄ½ųŠŠ£¬UŠĶ¹ÜÖŠÓźĖ® µÄĖįŠŌÖš½„¼õČõ
µÄĖįŠŌÖš½„¼õČõ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2016-2017ѧğÕć½Ź”ø߶žÉĻĘŚÖŠ»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
Ņ»¶ØĪĀ¶ČĻĀ£¬Į½øöŗćČŻĆܱÕČŻĘ÷ÖŠ·Ö±š·¢Éś·“Ó¦£ŗ
¢ŁH2(g)+I2(g) 2HI(g)£»
2HI(g)£»
¢ŚC(s)+H2O(g) CO(g)+H2(g)£¬ĻĀĮŠ×“Ģ¬ÄܱķĆ÷Į½·“Ó¦¶¼“ļµ½Ę½ŗāדĢ¬µÄŹĒ
CO(g)+H2(g)£¬ĻĀĮŠ×“Ģ¬ÄܱķĆ÷Į½·“Ó¦¶¼“ļµ½Ę½ŗāדĢ¬µÄŹĒ
a£®ø÷ĪļÖŹµÄÅØ¶Č²»±ä£»
b£®ČŻĘ÷ÄŚĘųĢåŃ¹Ēæ²»±ä£»
c£®ČŻĘ÷ÄŚĘųĢåĆÜ¶Č²»±ä£»
d£®ČŻĘ÷ÄŚĘųĢåŃÕÉ«²»±ä£»
e£®ø÷×é·ÖµÄĪļÖŹµÄĮæ·ÖŹż»ņÖŹĮæ·ÖŹż²»±ä£»
f£®»ģŗĻĘųĢåµÄĘ½¾ł·Ö×ÓĮæ²»±ä”£
A£®ae B£®aef C£®abc D£®ac
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2016-2017Ń§ÄźÉ½Ī÷Ź”ø߶žÉĻ10ŌĀŌĀæ¼»Æѧ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗĢīæÕĢā
·“Ó¦N2£Øg£©+3H2£Øg£© 2NH3£Øg£©£Ø”÷H£¼0£©ŌŚµČČŻĢõ¼žĻĀ½ųŠŠ”£øıäĘäĖū·“Ó¦Ģõ¼ž£¬ŌŚI”¢II”¢III½×¶ĪĢåĻµÖŠø÷ĪļÖŹÅضČĖꏱ¼ä±ä»ÆµÄĒśĻßČēĻĀĶ¼ĖłŹ¾£ŗ
2NH3£Øg£©£Ø”÷H£¼0£©ŌŚµČČŻĢõ¼žĻĀ½ųŠŠ”£øıäĘäĖū·“Ó¦Ģõ¼ž£¬ŌŚI”¢II”¢III½×¶ĪĢåĻµÖŠø÷ĪļÖŹÅضČĖꏱ¼ä±ä»ÆµÄĒśĻßČēĻĀĶ¼ĖłŹ¾£ŗ

»Ų“šĪŹĢā£ŗ
£Ø1£©ŌŚ3øö½×¶ĪÖŠ£¬N2µÄĘ½¾ł·“Ó¦ĖŁĀŹ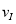 (N2)”¢
(N2)Ӣ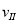 (N2)Ӣ
(N2)”¢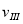 (N2)ÖŠ×ī“óµÄŹĒ £¬ĘäÖµŹĒ ”£
(N2)ÖŠ×ī“óµÄŹĒ £¬ĘäÖµŹĒ ”£
£Ø2£©H2µÄĘ½ŗā×Ŗ»ÆĀŹ¦Į¢ń(H2)”¢¦Į¢ņ(H2)”¢¦Į¢ó(H2)µÄ“󊔹ŲĻµŹĒ ”£
£Ø3£©ÓɵŚŅ»“ĪĘ½ŗāµ½µŚ¶ž“ĪĘ½ŗā£¬Ę½ŗāŅĘ¶ÆµÄ·½ĻņŹĒ £ØĢī”°Õż·“Ó¦·½Ļņ”±»ņ”°Äę·“ Ó¦·½Ļņ”±£©£¬²ÉČ”µÄ“ėŹ©ŹĒ ”£
Ó¦·½Ļņ”±£©£¬²ÉČ”µÄ“ėŹ©ŹĒ ”£
£Ø4£©µŚ¢ń½×¶ĪŹ±£¬»ÆŃ§Ę½ŗā³£ŹżK1£½ £»µŚ¢ņ”¢¢ó½×¶Ī»ÆŃ§Ę½ŗā³£ŹżK2 K3£»£ØĢī”°£¾”¢£¼”¢£½”±£©ÅŠ¶ĻµÄĄķÓÉŹĒ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2016-2017Ń§ÄźÉ½Ī÷Ź”ø߶žÉĻ10ŌĀŌĀæ¼»Æѧ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ŅŃÖŖ£ŗ2SO2(g)+O2(g) 2SO3”÷H£¼0”£Čō·“Ó¦ĪļĘšŹ¼ĪļÖŹµÄĮæĻąĶ¬£¬ĻĀĮŠ¹ŲÓŚøĆ·“Ó¦µÄŹ¾ŅāĶ¼²»ÕżČ·µÄŹĒ
2SO3”÷H£¼0”£Čō·“Ó¦ĪļĘšŹ¼ĪļÖŹµÄĮæĻąĶ¬£¬ĻĀĮŠ¹ŲÓŚøĆ·“Ó¦µÄŹ¾ŅāĶ¼²»ÕżČ·µÄŹĒ
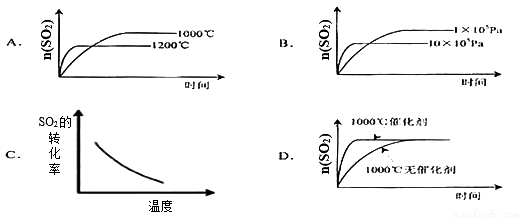
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2016-2017Ń§ÄźÉ½Ī÷Ź”ø߶žÉĻ10ŌĀŌĀæ¼»Æѧ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ŅŌĻĀ3×éČČ»Æѧ·½³ĢŹ½ÖŠQ1£¾Q2µÄŹĒ
¢Ł2H2S(g)+3O2(g)=2SO2(g)+2H2O(l)”÷H£½£Q1kJ/mol
2H2S(g)+O2(g)=2S(s)+2H2O(l)”÷H£½£Q2kJ/mol
¢ŚH+(aq)+OH-(aq)=H2O(l)”÷H£½£Q1kJ/mol
CH3COOH(aq)+OH-(aq)=CH3COO-(aq)+H2O(l)”÷H£½£Q2kJ/mol
¢ŪCH4(g)+2O2(g)=CO2(g)+2H2O(l)”÷H£½£Q1kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(g)”÷H£½£Q2kJ/mol
A£®¢Ł¢Ś B£®¢Ł¢Ś¢Ū C£®¢Ś¢Ū D£®¢Ś
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2016-2017ѧğ¹ć¶«Ź”ø߶žÉĻµŚ¶ž“ĪŌĀæ¼»Æѧ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ĻĀĮŠĖµ·Ø“ķĪóµÄŹĒ£Ø £©
A£®¾ŪĀČŅŅĻ©ĖÜĮĻ²»æÉÓĆĄ“°ü×°Ź³Ę·
B£®Č±µāŅ×»¼“ó²±×Ó²”
C£®ÓÉÓŚµķ·ŪŌŚČĖĢåÖŠ»į×Ŗ»ÆĪŖ°±»łĖį£¬Ņņ“ĖĆæĢģ¶¼ŅŖÉćČėŅ»¶ØĮæµÄµķ·Ū
D£®Ę¤·ō±»ĢĢÉĖ»ņŹÜÅØĻõĖįøÆŹ“Ź±£¬Ļø°ū½į¹¹½«ŹÜµ½ĘĘ»µ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2016-2017ѧğ¹ć¶«Ź”ĘÕÄžŹŠøßŅ»ÉĻŌĀ漶ž»Æѧ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗĢīæÕĢā
ĻÖÓŠŅ»¶ØĢå»żµÄHClĘųĢ壬½«ĘäČÜÓŚ100mLĻ”ĮņĖįÖŠ£¬¼ŁÉčČÜŅŗµÄĢå»ż²»±ä£¬Ļņ»ģŗĻČÜŅŗÖŠ¼ÓČė4mol•L£1µÄNaOHČÜŅŗ10mLĒ”ŗĆ³ŹÖŠŠŌ£®¼ĢŠųĻņĖłµĆÖŠŠŌČÜŅŗÖŠµĪČė¹żĮæµÄBa(OH)2 ČÜŅŗ£¬ĖłµĆ³ĮµķÖŹĮæĪŖ2.33g£®
£Ø1£©Éś³É³ĮµķµÄ»Æѧ·½³ĢŹ½ĪŖ_______________________£®
£Ø2£©ĮņĖįµÄĪļÖŹµÄĮæÅØ¶Č£ŗc(H2SO4) =_________________________£®
£Ø3£©øĆHClĘųĢåŌŚ±ź×¼×“æöĻĀµÄĢå»żĪŖ_____________mL£®
£Ø4£©ČōĻņøĆ»ģĖįČÜŅŗ£ØČŌĪŖ100mL£©ÖŠ¼ÓČėNa2CO3•10H2O¾§Ģ壬ֱµ½²»ŌŁ²śÉśĘųĢåŹ±ĪŖÖ¹£¬ĻūŗÄNa2CO3•10H2O¾§ĢåµÄÖŹĮæĪŖ____________g
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com