
 l3和盐酸的混合液中,充分反应后:
l3和盐酸的混合液中,充分反应后: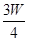 g,则溶液中的阳离子一定有 ,一定没有 .
g,则溶液中的阳离子一定有 ,一定没有 .科目:高中化学 来源:不详 题型:单选题
| A.7:1 | B.1:7 | C.7:8 | D.8:7 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 __________________________________现象,可证明磁铁矿石中存在+2价铁元素。
__________________________________现象,可证明磁铁矿石中存在+2价铁元素。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.N2O | B.NO | C.N2O3 | D.NO2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原混合物中n(Fe)∶n(Fe2O3)=2∶1 |
| B.向溶液中滴入KSCN溶液,显血红色 |
| C.无法计算原混合物的质量 |
| D.此时溶液中Fe2+和Fe3+的物质的量之比为3∶1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.亚硝酸盐是还原剂 | B.维生素C是氧化剂 |
| C.亚硝酸盐将Fe3+还原成Fe2+ | D.维生素C被Fe3+氧化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
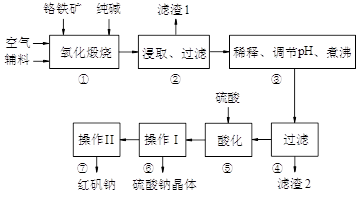
 8Na2CrO4 + 2Fe2O3 + 8CO2
8Na2CrO4 + 2Fe2O3 + 8CO2 2NaAlO2 + CO2↑等
2NaAlO2 + CO2↑等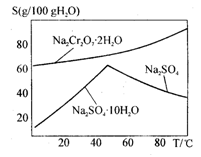
 是______(填序号)。
是______(填序号)。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 H2
H2 Cu
Cu CuSO4
CuSO4 Cu
CuA.一定消耗相同质 量的氧化铜 量的氧化铜 | B.一定消耗相同质量的锌 |
| C.一定消耗相同质量的稀硫酸 | D.一定生成相同质量的硫酸锌 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 。用此溶液进行以下实验:
。用此溶液进行以下实验: 应的化学方程式:
应的化学方程式:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com