
| A. | NH3:0.002 mol•L-1•s-1 | B. | H2O:0.0015 mol•L-1•s-1 | ||
| C. | NO:0.0015 mol•L-1•s-1 | D. | O2:0.00125 mol•L-1•s-1 |
分析 在2L的密闭容器中进行,1min后,NH3减少了0.12mol,则v(NH3)=$\frac{\frac{0.12mol}{2L}}{60s}$=0.001mol•L-1•s-1,结合速率之比等于化学计量数之比计算.
解答 解:在2L的密闭容器中进行,1min后,NH3减少了0.12mol,则v(NH3)=$\frac{\frac{0.12mol}{2L}}{60s}$=0.001mol•L-1•s-1,
由速率之比等于化学计量数之比可知,
v(NO)=0.001 mol•L-1•s-1,
v(H2O)=0.001 mol•L-1•s-1×$\frac{6}{4}$=0.0015 mol•L-1•s-1,
v(O2)=0.001 mol•L-1•s-1×$\frac{5}{4}$=0.00125 mol•L-1•s-1,
故选BD.
点评 本题考查化学反应速率与化学计量数的关系,为高频考点,把握速率的计算及与化学计量数的关系为解答的关键,侧重分析与计算能力的考查,题目难度不大.


 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源: 题型:解答题
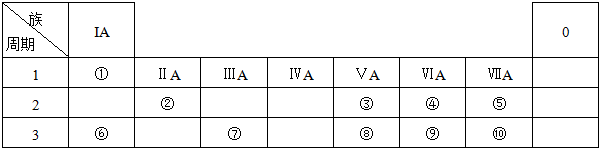
| 族 周期 | IA | 0 | ||||||
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
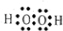
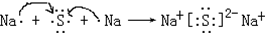
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
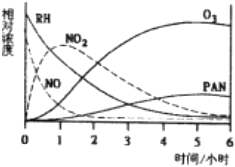
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯使溴水褪色 | |
| B. | 将苯滴入溴水中,振荡后水层接近无色 | |
| C. | 乙烯使酸性KMnO4溶液褪色 | |
| D. | 甲烷与氯气混合,黄绿色消失 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
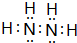
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
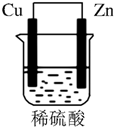 由铜片、锌片和200mL稀H2SO4组成的原电池中(如图所示装置),请按要求填空:
由铜片、锌片和200mL稀H2SO4组成的原电池中(如图所示装置),请按要求填空:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

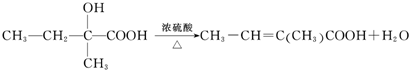
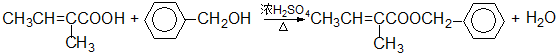
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com