
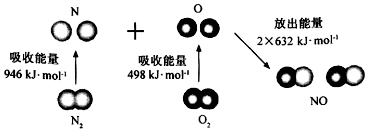
| A. | 直观看,该反应中反应物所具有的总能量低于生成物所具有的总能量 | |
| B. | 2 mol气态氧原子结合生成O2(g)时,能放出498 KJ能量 | |
| C. | 断裂1 mol NO分子中的化学键,需要吸收632KJ能量 | |
| D. | 该反应的热化学方程式为:N2+O2═2NO△H=+180KJ/mol. |
分析 A.依据焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量,计算分析,反应中反应物所具有的总能量高于生成物所具有的总能量是放热反应,反之是吸热反应;
B.原子结合形成分子的过程是化学键形成过程,是放热过程;
C.依据图示可知形成2molNO放热2×632KJ能量,所以1mol NO(g)分子中的化学键断裂时需要吸收632kJ能量;
D.反应焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量,并需注明物质的聚集状态.
解答 解:A.焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量,N2+O2═2NO△H=946kJ/mol+498kJ/mol-2×632kJ/mol=+180kJ/mol,反应是吸热反应,反应中反应物所具有的总能量低于生成物所具有的总能量,故A正确;
B.1mol O2(g)吸收498kJ能量形成2mol O原子,原子结合形成分子的过程是化学键形成过程,是放热过程,2mol O原子结合生成1mol O2(g)时需要放出498kJ能量,故B正确;
C.形成2molNO放热2×632KJ能量,所以1mol NO(g)分子中的化学键断裂时需要吸收632kJ能量,故C正确;
D.焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量,N2+O2═2NO△H=946kJ/mol+498kJ/mol-2×632kJ/mol=+180kJ/mol,热化学方程式无论反应物还是生成物必须标明聚集状态,焓变的数值和方程式的系数相对应,注明焓变的单位是kJ/mol,所以该反应的热化学方程式为:N2(g)+O2(g)═2NO(g)△H=+180KJ/mol,故D错误;
故选D.
点评 本题考查了反应能量变化的计算、热化学方程式正误判别,掌握热化学方程式的书写原则、反应热与键能的关系为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
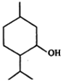
| A. | 薄荷醇分子中至少有12个碳原子共平面 | |
| B. | 薄荷醇分子式为C10H20O,它是环戊醇的同系物 | |
| C. | 1mol薄荷醇与足量NaHCO3反应生成22.4LCO2(标准状况) | |
| D. | 在一定条件下,薄荷醇能发生取代、中和、氧化等反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 物质 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
| 能量(kJ) | 243 | 193 | 151 | 431 | 366 | 298 | 436 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应除了生成新物质外,还伴随着能量的变化 | |
| B. | 物质燃烧和酸碱中和均放出热量 | |
| C. | 需要加热的反应肯定是吸热反应 | |
| D. | 化学反应是吸热的还是放热的取决于生成物具有的总能量和反应物具有的总能量的相对大小 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3、MgCl2 | B. | NH4HCO3、AlCl3 | C. | (NH4)2 CO3、BaCl2 | D. | NH4 HCO3、MgCl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com