
| A. | 葡萄糖在一定条件下可发生银镜反应 | |
| B. | 蔗糖和麦芽糖互为同分异构体 | |
| C. | 淀粉和纤维素互为同分异构体 | |
| D. | 油脂在体内酶的催化下水解得高级脂肪酸和甘油 |
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3O4与稀硝酸反应:Fe3O4+8 H+═2Fe3+十Fe2++4H2O | |
| B. | 向硫酸铵溶液中加入氢氧化钡溶液:Ba2++So4 2-═BaSO4↓ | |
| C. | 氯化铝溶液中加入过量氨水:Al3++3OH-═Al(OH)3↓ | |
| D. | 含0.4mol FeBr2溶液与0.4mol Cl2恰好反应:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2为0.4mol/L、O2为0.2mol/L | B. | SO3为0.4mol/L | ||
| C. | SO2、SO3均为0.15mol/L | D. | SO3为0.25mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合金都一定是两种金属熔合而成 | |
| B. | 涂料属于高分子材料,不属于合成材料 | |
| C. | 水泥与水搅拌静之后会凝固变硬,这是水泥的水硬性 | |
| D. | 我国的陶都和瓷都都是宜兴 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol NH4+ 所含质子数为10NA | |
| B. | 10克氖气所含原子数约为NA | |
| C. | 22.4 L SO2所含的分子数为NA | |
| D. | 2.3克金属钠变为钠离子时失去的电子数是0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 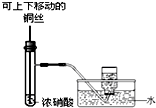 用如图所示装置,制备并收集少量NO2气体 | |
| B. | 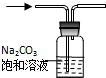 用如图所示装置,除去CO2中的HCl | |
| C. |  用图所示装置,制备Fe(OH)2并能较长时间观察其颜色 | |
| D. | 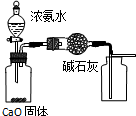 用图所示装置,所示装置制取并收集干燥纯净的NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据是否含氧元素,将物质分为氧化剂和还原剂 | |
| B. | 根据反应中是否有电子转移,将化学反应分为氧化还原反应和非氧化还原反应 | |
| C. | 根据水溶液是否能够导电,将物质分为电解质和非电解质 | |
| D. | 根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com