
| A. | Na+、K+、$S{O_4}^{2-}$、$HC{O_3}^-$ | B. | Cu2+、K+、$S{O_4}^{2-}$、$N{O_3}^-$ | ||
| C. | Na+、K+、Cl-、$S{O_4}^{2-}$ | D. | Fe2+、K+、$N{O_3}^-$、$C{H_3}CO{O^-}$ |
分析 溶液无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,酸性溶液中存在大量氢离子,
A.碳酸氢根离子与氢离子反应;
B.铜离子为有色离子,不满足溶液无色的条件;
C.四种离子之间不反应,都是无色离子,都不与氢离子反应;
D.亚铁离子为有色离子,不满足溶液无色的要求.
解答 解:溶液无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,酸性溶液中存在大量氢离子,
A.HCO3-与氢离子反应,在溶液中不能大量共存,故A错误;
B.Cu2+为有色离子,在溶液中不能大量共存,故B错误;
C.Na+、K+、Cl-、SO42-之间不发生反应,都不与氢离子反应,且为无色溶液,在溶液中能够大量共存,故C正确;
D.Fe2+为有色离子,不满足溶液无色的条件,故D错误;
故选C.
点评 本题考查离子共存的判断,题目难度中等,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在.


 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:解答题
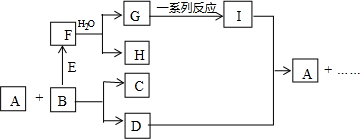
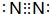 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
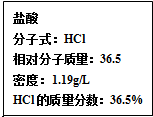 化学与人们生活质量的提高以及社会发展有着密切的关系.
化学与人们生活质量的提高以及社会发展有着密切的关系.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的标准燃烧热为-890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30 MPa下,将0.5 molN2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)$?_{500℃、30Mpa}^{催化剂}$2NH3(g)△H=-38.6 kJ•mol-1 | |
| C. | HCl和NaOH反应的中和热△H=-57.3 kJ•mol-1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ•mol-1 | |
| D. | 碳酸氢钠溶液中加入过量Ba(OH)2溶液:2HCO3-+Ba2++2OH-=BaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述反应中氧化产物只有N2 | |
| B. | 当有0.4molCO2生成时,反应中转移的电子的总数目约为1.204×1024 | |
| C. | 若上述反应生成0.4molCO2,则溶液中阴离子增加的物质的量为2mol | |
| D. | 现取1L含CN-1.02mg/L的废水,至少需用4.0×10-5molCl2处理后才符合排放标准 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
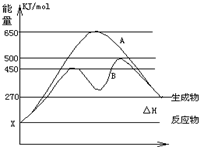 反应物与生成物均为气态的某可逆反应在不同条件下的反应历程分别为A、B,如图所示.试回答:
反应物与生成物均为气态的某可逆反应在不同条件下的反应历程分别为A、B,如图所示.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳和二氧化碳 | B. | 1mol 碳和3mol 碳 | ||
| C. | 3mol C2H2和1mol C6H6 | D. | 淀粉和纤维素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com