
 白的副产品绿矾制备还原铁粉的工业流程如下:
白的副产品绿矾制备还原铁粉的工业流程如下: 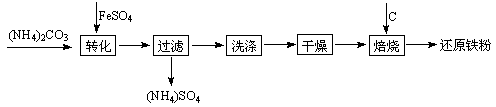
科目:高中化学 来源:不详 题型:单选题
| A.4.5 g | B.22.5 g | C.25 g | D.32 g |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Fe3+不与I-发生反应 |
| B.Fe3+与F-结合成不与I-反应的物质 |
| C.F-使I-的还原性减弱 |
| D.Fe3+被F-还原为Fe2+,使溶液中不再存在Fe3+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Cu、Fe3+ | B.Fe2+、Fe3+ | C.Cu、Cu2+ | D.Cu、Fe2+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.该灰黑色粉末用作抗氧化剂 |
| B.小纸袋中的粉末是Fe2O3 |
| C.小纸袋中可能装有活性铁粉 |
| D.该灰黑色粉末不可食用 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 的转化,A中Fe2+做 剂,B中Fe3+做 剂。
的转化,A中Fe2+做 剂,B中Fe3+做 剂。查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
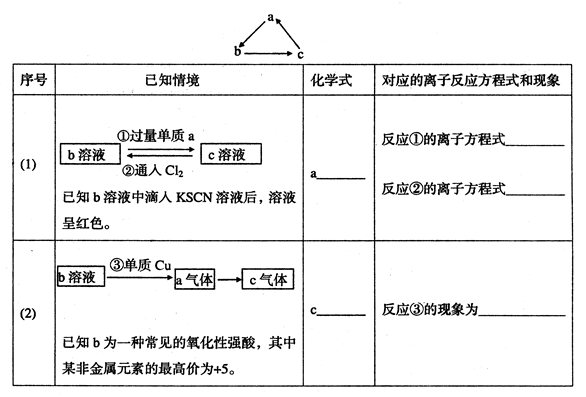
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com