
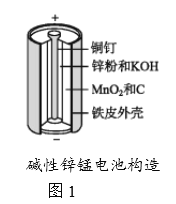
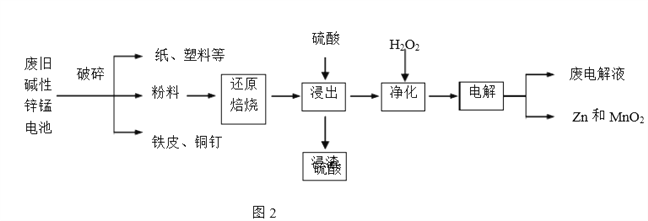
【题目】碱性锌锰电池是日常生活中消耗量最大的电池,其构造如图1所示。放电时总反应为Zn+2H2O+2MnO2![]() Zn(OH)2+2MnOOH,从废旧碱性锌锰电池中回收Zn和MnO2的工艺如下图2所示:
Zn(OH)2+2MnOOH,从废旧碱性锌锰电池中回收Zn和MnO2的工艺如下图2所示:
回答下列问题:
(1)碱性锌锰电池中,锌粉、MnO2、KOH的作用分别是(每空只选1个)_______、_______ 、______。
a.正极反应物b. 正极材料 c.负极反应物
d. 负极材料 e. 电子导体 f. 离子导体
(2)“还原焙烧”过程中,无需外加还原剂即可在焙烧过程中将MnOOH、MnO2还原为MnO,起还原作用的物质是___________。
(3)“净化”是在浸出液中先加入H2O2,再加入碱调节溶液pH到4.5左右,再过滤出沉淀。请完整说明这样操作的目的是______________。
Zn(OH)2 | Fe(OH)3 | Mn(OH)2 | |
开始沉淀的pH | 5.5 | 1.9 | 8.0 |
沉淀完全的pH | 8.0 | 3.2 | 10.0 |
(4) “电解”时,阳极的电极反应式为___。本工艺中应循环利用的物质是____(填化学式)。
(5)若将“粉料”直接与盐酸共热反应后过滤,滤液的主要成分是ZnCl2和MnCl2。“粉料”中的MnOOH与盐酸反应的化学方程式为_____。
(6)某碱性锌锰电池维持电流0.5 A(相当于每秒通过5×10-6 mol电子),连续工作80分钟即接近失效。如果制造一节电池所需的锌粉为6 g,则电池失效时仍有____%的金属锌未参加反应。
【答案】 c a f C /Zn 加入H2O2目的是将Fe2+氧化为Fe3+ 调节pH=4.5是使Fe3+完全沉淀而Mn2+、Zn2+ 仍以离子形式存在于溶液中 Mn2+-2e-+2H2O![]() MnO2+4H+ H2SO4 2MnOOH+6HCl
MnO2+4H+ H2SO4 2MnOOH+6HCl![]() Cl2↑+2MnCl2+4H2O 87
Cl2↑+2MnCl2+4H2O 87
【解析】(1)碱性锌锰干电池中,单质锌为负极反应物,负极材料为铁皮外壳,,石墨棒为正极材料,正极反应为二氧化锰,氢氧化钾相当于电解质溶液,所以答案依次为:c、a、f。
(2)电池中的碳粉和锌粉都是“还原焙烧”过程中的还原剂。
(3)加入过氧化氢的目的是将亚铁离子氧化为铁离子,再加入碱调节溶液的pH至4.5,将铁离子转化为氢氧化铁沉淀除去,这样避免沉淀溶液的锌离子。
(4)电解的溶液为硫酸锰和硫酸锌的混合溶液,因为电解要得到单质锌和二氧化锰,所以电解的阳极反应为Mn2+-2e-+2H2O![]() MnO2+4H+。根据阳极反应,得到溶液中会生成氢离子,因为Mn2+都转化为二氧化锰,锌离子都转化为单质,所以电解至最后应该得到硫酸,硫酸可以循环使用。
MnO2+4H+。根据阳极反应,得到溶液中会生成氢离子,因为Mn2+都转化为二氧化锰,锌离子都转化为单质,所以电解至最后应该得到硫酸,硫酸可以循环使用。
(5)因为“粉料”中的MnOOH与盐酸反应也是得到MnCl2的,所以Mn的化合价降低,只能是Cl化合价升高,因此生成物为氯气,根据化合价升降相等和原子个数守恒得到:2MnOOH+6HCl![]() Cl2↑+2MnCl2+4H2O。
Cl2↑+2MnCl2+4H2O。
(6)每秒通过5×10-6 mol电子,连续工作80分钟,则通过电子为5×10-6 ×80×60=0.024mol。所以参加反应的单质锌为0.012mol,质量为0.78g,所以剩余的锌为6-0.78=5.22g,所以剩余锌为5.22/6=87%。


科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列叙述正确的是( )
A. 标准状况下,5.6LHF中含有电子数为2.5NA
B. 50g质量分数为46%的乙醇溶液中,氢原子的总数为3NA
C. 1 molNa2O2固体中含阴离子总数为2NA
D. 0.1 molH2和0.1 mol I2 于密闭容器中充分反应,其分子总数为 0.2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年IUPAC命名117号元素为TS(中文名![]() ,tián),TS的原子核外最外层电子数是7.下列说法不正确的是( )
,tián),TS的原子核外最外层电子数是7.下列说法不正确的是( )
A. TS是第七周期第ⅦA族元素 B. TS的同位素原子具有相同的电子数
C. TS在同族元素中非金属性最弱 D. 中子数为176的TS核素符号是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是现代社会发展的支柱之一。
(1)化学反应中的能量变化,通常主要表现为热量的变化。
①下列反应中,属于放热反应的是___________(填序号)。
a. Ba(OH)2·8H2O与NH4Cl混合搅拌
b. 高温煅烧石灰石
c. 铝与盐酸反应
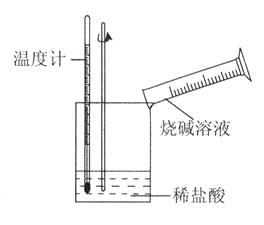
②某同学进行如下图所示实验,测量稀盐酸与烧碱溶液中和反应的能量变化。实验表明:反应温度升高,由此判断该反应是_______(填“吸热”或“放热”)反应,其离子方程式是_______________。
(2)电能是现代社会应用最广泛的能源之一。
下图所示的原电池装置中,其负极是_____________________,正极上能够观察到的现象是____________________________,正极的电极反应式是_________________________。
原电池工作一段时间后,若消耗锌6.5g,则放出气体__________g。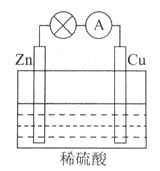
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列四个常用电化学装置的叙述正确的是( )
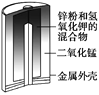
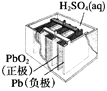
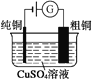
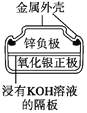
图1 碱性锌锰电池 图2 铅—硫酸蓄电池 图3 电解精炼铜 图4 银锌纽扣电池
A. 图1所示电池中,MnO2的作用是催化剂
B. 图2所示电池放电过程中,硫酸浓度不断增大
C. 图3所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D. 图4所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由配位键形成的离子[Pt(NH3)6]2+和[PtCl4]2—中,两个中心离子铂的化合价是( )
A.都是+8 B.都是+6 C.都是+4 D.都是+2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示反应M(g)+P(g) ![]() nQ(g)的平衡体系中,Q的物质的量浓度c(Q)与温度T的关系(曲线上的点表示平衡状态)。下列有关该反应的描述错误的是( )
nQ(g)的平衡体系中,Q的物质的量浓度c(Q)与温度T的关系(曲线上的点表示平衡状态)。下列有关该反应的描述错误的是( )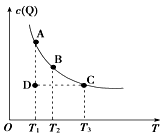
A.通过分析题图,该反应的正反应为放热反应
B.A状态与C状态的化学反应速率比较为v(A)<v(C)
C.在T1、D状态时,v正<v逆
D.在T2、B状态时,改变体积始终有v正=v逆 , 则n=2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述不正确的是( )
A.二氧化硅可用于制造光导纤维
B.石英玻璃可用于制造光学仪器
C.玻璃在加热融化时有固定的熔点
D.制普通玻璃的原料是纯碱、石灰石、石英
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,可逆反应X(g)+3Y(g) ![]() 2Z(g) 达到平衡的标志是( )
2Z(g) 达到平衡的标志是( )
A. 单位时间内生成 1 molX,同时生成 3 molY
B. X, Y, Z的浓度相等
C. X, Y, Z的分子数比为1:3:2
D. 单位时间内生成 1 molX,同时生成2 molZ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com