
下列各组中的两种物质作用,反应条件(温度或者反应物用量)改变,不会引起产物种类改变的是( )
A.Na和O2 B.Na2O2和CO2
C.NaOH和CO2 D.AlCl3和NaOH
科目:高中化学 来源: 题型:
已知:将一定量Cl2通入KOH溶液,可能生成KCl、KClO、KClO3,且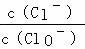 的值与温度高低有关.当n(KOH)=6a mol时,下列有关说法错误的是( )
的值与温度高低有关.当n(KOH)=6a mol时,下列有关说法错误的是( )
|
| A. | 若某温度下,反应后 |
|
| B. | 参加反应的氯气的物质的量等于3a mol |
|
| C. | 改变温度,反应中转移电子的物质的量ne的范围:3a mol<ne<5a mol |
|
| D. | 改变温度,产物中KClO3的最大理论产量为a mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
反应A(g)+3B(g)===2C(g)+2D(g),在不同情况下测得的反应速率如下,其中反应速率最大的是( )
A.v(D)=0.4 mol·L-1·s-1 B.v(C)=0.5 mol·L-1·s-1
C.v(B)=0.6 mol·L-1·s-1 D.v(A)=0.15 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
将固体NH4I置于密闭容器中,在一定温度下发生下列反应:
①NH4I(s) NH3(g)+HI(g);
NH3(g)+HI(g);
②2HI(g) H2(g)+I2(g)
H2(g)+I2(g)
达到平衡时,c(H2)=0.5mol·L-1,c(HI)=4mol·L-1,则此温度下反应①的平衡常数为( )
A.9 B.16 C.20 D.25
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.硫酸和磷酸的摩尔质量不相等
B.18 g水中含有1 mol水
C.O2的摩尔质量(单位是g·mol-1)在数值上等于其相对分子质量
D.1 mol CO的质量是28 g·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各元素的氧化物中,既能与盐酸反应,又能够与NaOH溶液反应的是( )
A.元素X:它的原子中M层比L层少2个电子
B.元素Y:它的二价阳离子核外电子总数与氩原子相同
C.元素Z:位于元素周期表中的第三周期第ⅢA族
D.元素W:它的焰色反应颜色呈浅紫色
查看答案和解析>>
科目:高中化学 来源: 题型:
现有金属单质A、B和气体甲、乙、丙以及物质C、D、E、F,它们之间能发生如下反应。(图中有些反应的产物和反应条件没有标出)

请回答下列问题:
(1)A的化学式为 ,丙的化学式为 ;
(2)写出下列反应的离子方程式:
① ;
④ ;
⑤ 。
(3)写出C溶液与Al反应的化学方程式: 。
(4)将Na2O2投入到E溶液中,可以观察到的现象是: 。
(5)为鉴定B单质,将试样溶于稀盐酸,取上层清液后需再加入的试剂(填写字母代号)是 。
a. 碘水 b. 氯水 c. NaOH溶液 d. KSCN溶液 e. Na2SO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室用乙酸和正丁醇制备乙酸正丁酯。有关物质的相关数据如下表。
| 化合物 | 相对分子质量 | 密度/g·cm-3 | 沸点/℃ | 溶解度/100g水 |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
(一)乙酸正丁酯的制备
①在干燥的50mL圆底烧瓶中,加入13.5mL正丁醇和7.2mL冰醋酸,再加入3~4滴浓硫酸,摇匀,投入1~2粒沸石。然后安装分水器(作用:实验过程中不断分离除去反应生成的水)、温度计及回流冷凝管,加热冷凝回流反应
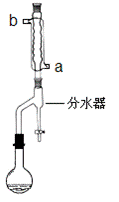
(二)产品的精制
②将分水器分出的酯层和反应液一起倒入分液漏斗中,用10 mL的水洗涤。有机层继续用10 mL10%Na2CO3洗涤至中性,再用10 mL 的水洗涤,最后将有机层转移至锥形瓶中,再用无水硫酸镁干燥。
③将干燥后的乙酸正丁酯滤入50 mL 烧瓶中,常压蒸馏,收集125~127 ℃的馏分,得11.6 g乙酸正丁酯
请回答有关问题。
(1)冷水应该从冷凝管 ___________(填a或b)管口通入。
(2)步骤①中不断从分水器下部分出生成的水的目的是_________________________
步骤①中判断反应终点的依据是_____________________________________。
(3)产品的精制过程步骤②中,第一次水洗的目的是_____________________________,用饱和Na2CO3溶液洗涤有机层,该步操作的目的是_________________________________。
(4)下列关于分液漏斗的使用叙述正确的是____
A.分液漏斗使用前必须要检漏,只要分液漏斗的旋塞芯处不漏水即可使用
B.装液时,分液漏斗中液体的总体积不得超过其容积的2/3
C.萃取振荡操作应如右图所示
D.放出液体时,需将玻璃塞打开或使塞上的凹槽对准漏斗口上的小孔
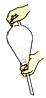
(5)步骤③的常压蒸馏,需收集126℃的馏分,沸点大于140℃的有机化合物的蒸馏,一般不用上述冷凝管而用空气冷凝管,可能原因是_________________________
(6)该实验过程中,生成乙酸正丁酯(式量116)的产率是__________
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA表示阿伏加德罗常数的值。下列叙述正确的是
A. 标准状况下,11.2 L乙醇中含有的碳氢键数为2.5NA
B. 常温常压下,28 g C2H4、C O的混合气体中含有碳原子的数目为1.5NA
O的混合气体中含有碳原子的数目为1.5NA
C.常温下,20 L pH=12的Na2CO3溶液中含有的OH-离子数为0.2NA
D. 标准状况下,2.24 L Cl2与足量的NaOH溶液反应,转移的电子数目为0.2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com