
| A. | 常温下,0.1 mol•L-1Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| B. | 常温下,0.1 mol•L-1HA溶液与0.1 mol•L-1 NaOH溶液正好完全反应时,溶液中一定存在:c(Na+)=c(A-)>c(OH-)=c(H+) | |
| C. | 常温下,pH=7的CH3COONa和CH3COOH混合溶液中c(Na+)=0.1 mol•L-1:c(Na+)=c(CH3COOH)>c(CH3COO-)>c(H+)=c(OH-) | |
| D. | 常温下,向0.1 mol•L-1CH3COOH 溶液加水稀释,当溶液的pH从3.0升到4.0时,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$的值增大到原来的10倍 |
分析 A.根据硫化钠溶液中的质子守恒判断;
B.若HA为弱酸,则A-在溶液中部分水解,溶液显示碱性,则c(Na+)>c(A-)、c(OH-)>c(H+);
C.常温下,pH=7的CH3COONa和CH3COOH混合溶液中,醋酸的浓度减小,c(CH3COOH)<c(CH3COO-)
D.根据醋酸的电离平衡常数可知:$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=$\frac{{K}_{a}}{c({H}^{+})}$,氢离子浓度与该比值成正比.
解答 解:A.常温下,0.1 mol•L-1Na2S溶液中,根据质子守恒可得:c(OH-)=c(H+)+c(HS-)+2c(H2S),故A错误;
B.常温下,0.1 mol•L-1HA溶液与0.1 mol•L-1 NaOH溶液正好完全反应时,如果HA为弱电解质,则反应生成强碱弱酸盐NaA,溶液显示碱性,则c(Na+)>c(A-)、c(OH-)>c(H+),溶液中正确的离子浓度为:c(Na+)>c(A-)>c(OH-)>c(H+),故B错误;
C.常温下,pH=7的CH3COONa和CH3COOH混合溶液中,c(H+)=c(OH-),根据电荷守恒可知:c(Na+)=c(CH3COO-),溶液中正确的离子浓度大小为:c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-),故C错误;
D.常温下,向0.1 mol•L-1CH3COOH 溶液加水稀释,当溶液的pH从3.0升到4.0时,氢离子浓度增大减小10倍,而溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=$\frac{{K}_{a}}{c({H}^{+})}$,则该比值增大到原来的10倍,故D正确;
故选D.
点评 本题考查了离子浓度大小比较,题目难度中等,明确质子守恒、电荷守恒及盐的水解原理为解答关键,选项D注意电离平衡常数表达式的变形,试题培养了学生的分析、理解能力.


科目:高中化学 来源: 题型:选择题
| A. | 原子晶体 | B. | 离子晶体 | C. | 分子晶体 | D. | 金属晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A~F六种元素中,除C外其他均为短周期元素,它们的原子结构或性质如下表所示.
A~F六种元素中,除C外其他均为短周期元素,它们的原子结构或性质如下表所示.| 元素 | 原子结构或性质 |
| A | 原子最外层电子数是内层电子总数的$\frac{1}{5}$ |
| B | 形成化合物种类最多的元素,其单质为固体 |
| C | 生活中常见的金属,它有两种常见的氯化物,且相对分子质量相差35.5 |
| D | 地壳中含量最多的元素 |
| E | 与D同主族 |
| F | 与E同周期,且最外层电子数等于电子层数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | R的最高价氧化物对应的水化物的酸性比X的弱 | |
| B. | 非金属性:Y>X | |
| C. | 原子半径的大小顺序:X>Z | |
| D. | Z元素最高价氧化物对应的水化物具有两性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3、H2O、PCl3都是极性分子 | B. | CO2的分子示意图: | ||
| C. | H2O2的电子式: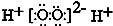 | D. | CS2、C6H6、C2H2都是直线型分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
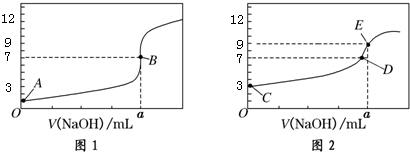
| A. | 图1是滴定CH3COOH 溶液的曲线 | |
| B. | 图2若用甲基橙作指示剂达到滴定终点时,则溶液由黄色变为红色 | |
| C. | 点D所示溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 如果C、E两点对应的pH分别为3、9,则水电离的氢离子浓度之比为1:100 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
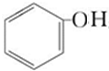 D
D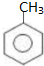
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
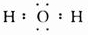
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com