
AX(g)+2X2(g) AX5(g)在容积为10L恒定不变的密闭容器中进行。起始时AX和X2均为1.3mol,分三组进行实验,每组只改变一个条件且改变条件均不同。反应体系总压强随时间的变化如图所示。(计算结果均保留两位有效数字)
AX5(g)在容积为10L恒定不变的密闭容器中进行。起始时AX和X2均为1.3mol,分三组进行实验,每组只改变一个条件且改变条件均不同。反应体系总压强随时间的变化如图所示。(计算结果均保留两位有效数字)
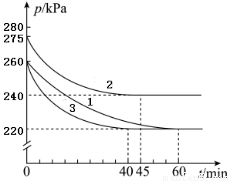
(1)计算实验1反应开始至达到平衡时的反应速率v(AX5)=________________。
(2)图中3组实验从反应开始至达到平衡时的反应速率v(AX5)由大到小的次序为______(填实验序号);
与实验1相比,其他两组改变的实验条件及判断依据是:2____________,3_________。
(3)用p1表示开始时总压强,p2表示平衡时总压强,α表示AX的平衡转化率,则α的表达式为____________;实验1和2的平衡转化率:α1为___________,α2为_________________。
科目:高中化学 来源:2016届安徽马鞍山、淮北、铜陵四校高三上第三次联考化学试卷(解析版) 题型:实验题
在无机化工中,硫酸亚铁铵[(NH4)2Fe(SO4)2]是制取其它铁系化合物的原料,如制取氧化伯系颜料、磁性材料和黄血盐等。某化学兴趣小组设计如下实验方案,探究(NH4)2Fe(SO4)2完全分解的产物。
已知:①隔绝空气受热完全分解是氧化还原反应。
②98%浓硫酸能顺利吸收SO3。
Ⅰ.甲同学根据以下流程探究分解的部分产物,试回答下列问题:
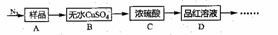
(1)B装置预期的现象是_____;C装置的作用可能是______,D装置可以检验分解产物中是否含有_____。
(2)加热前先通一会儿N2,再关闭气阀,其目的是_______。
Ⅱ.乙同学猜想(NH4)2Fe(SO4)2分解时可能生成了SO3,为了验证他的猜想,小组同学又提供了如右图装置,试回答下列问题:
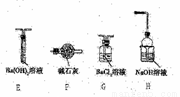
(3)不能选择E和F装置的原因是________。
(4)加热装置A与G、H连接并进行实验,请你提出需要改进的方案________。
(5)已知饱和SO2水溶液中c(SO32-)=6.0×10-8mol•L-1,Ksp(BaSO3)=5.4×10-7。通过计算判断在1.0mol•L-1的BaCl2溶液中,通入足量纯净的SO2能否生成BaSO3沉淀?
(6)当G中出现大量白色沉淀时,并不能说明A中生成了SO3,理由是_______;为了进一步证明是否有SO3生成,请你补充实验方案(不要求写具体的操作过程)_________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南常德石门第一中学高一上期中化学试卷(解析版) 题型:选择题
已知1.505×1023个X气体分子的质量为8g,则X气体的摩尔质量是( )
A.16g B.32g C.64g /mol D.32g /mol
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南常德石门第一中学高二上期中文化学卷(解析版) 题型:选择题
果汁是人们喜爱的饮料,由于其中含有Fe2+,在榨取后不久往往会变为棕黄色,生产上常在其中加入维生素C以防止其变色,这是利用了维生素C的
A.氧化性 B.还原性 C.酸性 D.碱性
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三上第三次模拟化学试卷(解析版) 题型:选择题
用无机矿物资源生产部分材料,其产品流程示意图如下。下列有关说法不正确的是( )
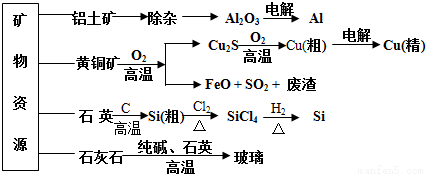
A.制取玻璃的同时产生CO2气体,制取粗硅时生成的气体产物为CO
D.生产高纯硅、铝、铜及玻璃的过程中都涉及氧化还原反应
C.粗硅制高纯硅时,提纯四氯化硅可用多次蒸馏的方法
B.黄铜矿冶炼铜时产生的SO2可用于生产硫酸,FeO可用作冶炼铁的原料
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南常德石门第一中学高二上期中理化学卷(解析版) 题型:选择题
700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:
CO(g)+ H2O(g) CO2 (g)+ H2(g)
CO2 (g)+ H2(g)
反应过程中测定的部分数据见下表(表中t2>t1):
反应时间/min | n(CO)/mol | n(H2O)/mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
下列说法正确的是
A.反应在t1min内的平均速率为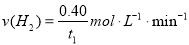
B.保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时n(CO2)= 0.40mol
C.保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时H2O转化率增大
D.温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三上学期二次质检化学试卷(解析版) 题型:推断题
短周期主族元素X、Y、Z、M、N,且原子序数依次增大,已知Y原子最外层电子数与核外电子总数之比为3:4,M原子的最外层电子数与次外层电子数之比为3:4且M原子的质子数是Y原子的2倍,N-、Z+、X+的半径逐渐减小,化合物XN在常温下为气体,据此回答下列问题
(1)写出Z与N形成化合物的电子式____ _。
(2)X与Y可分别形成10电子和18电子的分子,写出该18电子分子转化成10电子分子的化学方程式__ __(分解反应)。
(3)下图表示由上述元素组成的两种气体分子在一定条件下的密闭容器中充分反应前后的转化关系,请写出该转化过程的化学方程式:___ _ _。
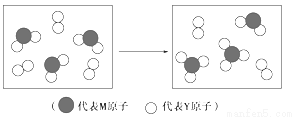
(4)A、B均为由上述五种元素中的三种元素组成的强电解质,且组成元素的原子个数之比为1:1:1。若在各自的水溶液中,A能抑制水的电离,B能促进水的电离,则A的化学式为____,B的化学式为_______。A、B之间反应的离子方程式为 。A中存在的化学键类型为: 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省高二上第二次月考化学试卷(解析版) 题型:选择题
某温度下,密闭容器中X、Y、Z、W四种气体的初始浓度和平衡浓度如下表 ,下列说法错误的是( )
,下列说法错误的是( )
物质 | X | Y | Z | W |
初始浓度/mol·L-1 | 0.5 | 0.6 | 0 | 0 |
平衡浓度/mol·L-1 | 0.1 | 0.1 | 0.4 | 0.6 |
A.反应达到平衡时,X的转化率为80%
 B.该反应的平衡常数表达式为K=
B.该反应的平衡常数表达式为K=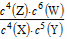
C.增大压强其平衡常数不变,但使平衡向生成Z的方向移动

 D.改变温度可以改变此反应的平衡常数
D.改变温度可以改变此反应的平衡常数
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东深圳高级中学高一上期中考试化学试卷(解析版) 题型:选择题
下列叙述错误的是 ( )
A.标准状况下,5LCH4气体与5LNH3气体的原子个数之比为5:4
B.常温常压下,11.2LO3中所含氧原子个数等于1.5NA
C.同温、同压下,相同体积的N2和CO气体具有 相同的分子数和相同的密度
相同的分子数和相同的密度
D.同温、同压下,等质量的一氧化碳和二氧化碳的密度比为7:11
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com