
【题目】下列有关活化分子和活化能的说法不正确的是
A.增加气体反应物的浓度可以提高活化分子百分数
B.升高温度可增加单位体积活化分子数
C.发生有效碰撞的分子一定是活化分子
D.使用催化剂可降低活化能,提高活化分子百分数
科目:高中化学 来源: 题型:
【题目】有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如图所示的实验装置,通过测量反应产生的CO2和H2O的质量,来确定该混合物中各组分的质量分数。

(1)实验步骤:
①按图(夹持仪器未画出)组装好实验装置后,首先进行的操作是 。
②称取样品,并将其放入硬质玻璃管中;称量装浓硫酸的洗气瓶C的质量和装碱石灰的U形管D的质量。
③打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟,其目的是______________________。
④关闭活塞K1、K2,打开K3,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为____________ 、 。
⑤打开活塞K1,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C的质量和U形管D的质量。
(2)关于该实验方案,请回答下列问题。
①若加热反应后不鼓入空气,对测定结果的影响是NaCl________NaHCO3__________ Na2CO3·10H2O__________(填“偏大”“偏小”或“无影响”)
②E处干燥管中盛放的药品是___________,其作用是__________ ,如果实验中没有该装置,则会导致测量结果NaHCO3的质量分数___________(填写同①)。
③若样品质量为10.0 g,反应后C、D装置增加的质量分别为2.7 g、2.2 g,则混合物中Na2CO3·10H2O的质量分数为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组拟用浓盐酸与二氧化锰加热反应,制取并收集2瓶干燥、纯净的氯气。为防止换集气瓶时生成的氯气污染空气,设计了如下装置:

(1)写出Ⅰ装置烧瓶中发生的反应的离子方式: 。
(2)装置Ⅱ中盛放的药品是饱和氯化钠溶液,其作用是 ;装置Ⅲ的作用是干燥氯气,应盛放___________。
(3)实验开始后,先 a b(填“关闭”或“打开”,下同);当集满一瓶氯气时,为减少换集气瓶时氯气的外溢,再 a b,换好集气瓶后,继续收集氯气
(4)兴趣小组的某些同学准备在烧杯中加入下列溶液中的一种来吸收残余氯气,你认为其中不恰当的是(填序号) 。
A.氢氧化钠溶液 B.浓硫酸 C.水
(5)氯气是重要的化工原料,以乙烯、氯气、氢氧化钙和水等物质为原料制取环氧乙烷(C2H4O),教材中介绍经典的方法包括两部反应:
①CH2=CH2+Cl2+H2O→ClCH2CH2OH+HCl
②ClCH2CH2OH+HCl+Ca(OH)2→C2H4O+CaCl2+2H2O
根据以上两步,求生成环氧乙烷的原子利用率为 %。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1000mL某待测液中除含有0.2mol.L-1的Na+外,还可能含有下列离子中的一种或多种:
阳离子 | K+、NH4+、Fe3+、Ba2+ |
阴离子 | Cl-、Br-、CO32-、HCO3-、SO32-、SO42- |
现进行如下实验操作(每次实验所加试剂均过量):
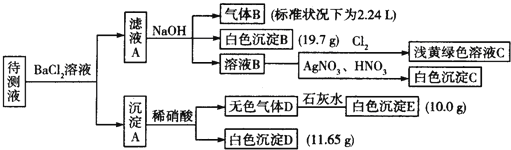
(1)写出生成白色沉淀B的离子方程式: 。
(2)待测液中肯定不存在的阳离子是 。
(3)若无色气体D是单一气体:
阴离子 | Cl- | Br- | CO32- | HCO3- | SO32- | SO42-11777437 |
浓度/mol.L — |
①将阴离子的物质的量浓度填入上表中(一定不存在的填“0”,不能确定的填“?”):
②判断原溶液中K+是否存在,若存在,求其物质的量浓度的最小值,若不存在,请说明理由: 。
(4)若无色气体D是混合气体:
①待测液中一定含有的阴离子是 。
②沉淀A中能与稀硝酸反应的成分是 (写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石墨作电极电解1 mol/L CuSO4溶液,当c(Cu2+)为0.5 mol/L时,停止电解,向剩余溶液中加入下列何种物质可使电解质溶液恢复至原来状态( )
A. CuCO3 B. CuSO4 C. Cu(OH)2 D. CuSO4·5H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在aL Al2(SO4)3和(NH4)2SO4的混合物溶液中加入b mol BaC12,恰好使溶液中的SO42-离子完全沉淀,如加入足量强碱并加热可得到cmol NH3气,则原溶液中的A13+离子浓度(mol/L)为( )
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列说法正确的有几个
①在常温常压下,1mol氦气含有原子数为2NA
②0.5molO2和0.5molO3的混合物所含有的氧原子个数为2.5NA
③常温常压下,18 g H2O中含有的原子总数为3NA
④常温常压下,2.24 LCO和CO2混合气体中含有的碳原子数目为0.1NA
⑤含NA个Na+的Na2O溶解于1 L水中,Na+的物质的量浓度为1 mol·L-1
⑥1.00 mol NaCl中,所有Na+的最外层电子总数为8×6.02×1023
⑦1 mol·L-1 NaCl溶液含有NA个Na+
⑧常温常压下,92 g的NO2和N2O4混合气体含有的原子数为6NA
⑨13.5g Al与足量盐酸反应生成H2的分子数为NA
⑩标准状况下,2.24LCH4所含电子数为NA
A.3 B.4 C.5 D.6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiPF6是锂离子电池中广泛应用的电解质。某工厂用LiF、PCl5为原料,低温反应制备LiPF6,其流程如下:
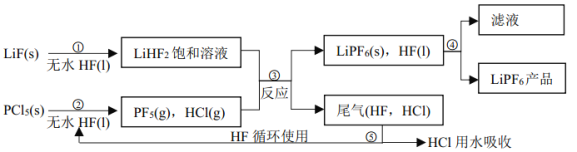
已知: HCl的沸点是-85.0℃,HF的沸点是 19.5℃。
(1)第①步反应中无水 HF 的作用是_____________、___________。反应设备不能用玻璃材质的原因是_______________(用化学方程式表示)。
(2)该流程需在无水条件下进行,第③步反应中PF5极易水解,其产物为两种酸,写出PF5水解的化学方程式:____________。
(3)第④步分离采用的方法是__________;第⑤步分离尾气中 HF、 HCl 采用的方法是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用化学用语回答下列问题
(1)写出NaHSO4在水中的电离方程式 。
(2)NH4Cl和熟石灰共热制氨气的化学方程式: 。
(3)氢氧化钠溶液中通入少量CO2气体的方程式 。
(4)Fe2O3和CO在高温条件下反应炼出单质铁的方程式 。
(5)高锰酸钾受热分解的化学方程式 。
(6)区分溶液和胶体的方法是 ,分离溶液和胶体的操作是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com