
| A. | NO可以由Cu和稀硝酸反应制得? | |
| B. | NO不会造成空气污染,是一种无害气体 | |
| C. | NO可以由N2在O2中燃烧制得? | |
| D. | NO是红棕色气体 |
科目:高中化学 来源: 题型:解答题

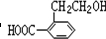
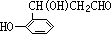 ;
;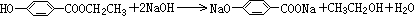 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)从不同的角度,化学反应可以有不同的分类方法,不同类别的化学反应间又有一定的联系,请在如图的方框中,用图示(每个圆圈代表一类
(1)从不同的角度,化学反应可以有不同的分类方法,不同类别的化学反应间又有一定的联系,请在如图的方框中,用图示(每个圆圈代表一类查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 麦芽糖及其水解产物均能发生银镜反应 | |
| B. | 用溴水即可鉴别苯酚溶液,2,4-己二烯和甲苯 | |
| C. | 乙酸乙酯和食用植物油均可水解生成乙醇 | |
| D. | 溴乙烷与NaOH乙醇溶液共热生成乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com