
【题目】烃基异构化是当前环保的急切要求,正戊烷异构化为异戊烷的热化学方程式是: CH3CH2CH2CH2CH3![]() CH3CH(CH3)CH2CH3 △H=-7.1 kJ·mol-1
CH3CH(CH3)CH2CH3 △H=-7.1 kJ·mol-1
(1)正戊烷异构化反应选择的温度条件是____________。
(2)由于副反应较为复杂,提髙产率的最佳方法是____________。
(3)如果提高温度,反应速率___________,转化率___________(填“升高"“不变”或“降低” ),同时还会产生积炭现象,假如在反应物中掺入一定量水,则可以减弱这种现象,理由是___________(用化学方程式表示)。
(4)在573 K时,正戊烧转化率为54%,则此时平衡常数为___________(保留两位有效数字)。
【答案】 相对低温或低温 低温高效催化剂或催化剂 加快 降低 C+H2O![]() CO+H2 1.2
CO+H2 1.2
【解析】(1)CH3CH2CH2CH2CH3![]() CH3CH(CH3)CH2CH3 △H=-7.1 kJ·mol-1 是放热反应,降温平衡正向移动,正戊烷异构化反应选择的温度条件是相对低温或低温;(2)由于副反应较为复杂,提髙产率的最佳方法是低温高效催化剂或催化剂;(3)如果提高温度,平衡逆向移动,反应速率加快,但转化率降低,积碳在高温下与水反应,生成氢气和一氧化碳,C+H2O
CH3CH(CH3)CH2CH3 △H=-7.1 kJ·mol-1 是放热反应,降温平衡正向移动,正戊烷异构化反应选择的温度条件是相对低温或低温;(2)由于副反应较为复杂,提髙产率的最佳方法是低温高效催化剂或催化剂;(3)如果提高温度,平衡逆向移动,反应速率加快,但转化率降低,积碳在高温下与水反应,生成氢气和一氧化碳,C+H2O![]() CO+H2 ;
CO+H2 ;
(4)在573 K时,正戊烧转化率为54%,产物为0.54份,余下的为1-0.54=0.46,则此时平衡常数为0.54/0.46=1.2


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】早在1807年化学家戴维用电解熔融氢氧化钠制得钠:4NaOH(熔) ![]() 4Na + O2↑+ 2H2O;后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠:3Fe + 4NaOH
4Na + O2↑+ 2H2O;后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠:3Fe + 4NaOH ![]() Fe3O4 + 2H2↑ + 4Na↑。下列有关说法正确的是( )
Fe3O4 + 2H2↑ + 4Na↑。下列有关说法正确的是( )

A.电解熔融氢氧化钠制钠,阳极发生电解反应2OH--2e-===H2↑+O2↑
B.盖·吕萨克法制钠原理是利用铁的还原性比钠强
C.若戴维法与盖·吕萨克法制得等量的钠,则两反应中转移的电子总数不同
D.目前工业上常用电解熔融氯化钠法制钠(如上图),电解槽中石墨极为阴极,铁为阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于铅蓄电池的说法正确的是
A. 在放电时,正极发生的反应是Pb+SO42-=PbSO4+2e-
B. 在放电时,该电池的负极材料是铅板
C. 在充电时,电池中硫酸的浓度不断变小
D. 在充电时,阳极发生的反应是PbSO4+2e-=Pb+SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于晶体的结构和性质的叙述正确的是( )
A. 分子晶体中一定含有共价键
B. 原子晶体中共价键越强,熔点越高
C. 离子晶体中含有离子键,不含有共价键
D. 金属阳离子只能存在于离子晶体中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化学发展史的说法错误的是网]
A. 中国科学家成功合成了结晶牛胰岛素,标志着人类合成蛋白质时代的开始
B. 德国化学家李比希提出运用同位素示踪法研究化学反应历程
C. 瑞典科学家贝采利乌斯提出有机化学的概念,使之成为化学的一个重要分支
D. 德国化学家维勒用氰酸铵合成尿素,从而打破了无机物和有机物的界限
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把含硫酸铵和硝酸铵的混合液a L分成两等份.一份加入含b mol NaOH的溶液并加热,恰好把NH3全部赶出;另一份需消耗c mol BaCl2才能使SO42﹣完全沉淀,则原溶液中NO3﹣的物质的量浓度为( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷及其化合物与人类生产、生活密切相关。请回答下列问题:
(1)少量CO的存在会引起生产中催化剂中毒,常用SO2氧化CO,本身被还原为S。
已知:① Cc(s)+ 1/2O2 (g)=CO (g) △H1=-l26.4kJ·mol-1
②③C(s)+O2 (g) =CO2 (g) △H2=-393.5kJ·mol-1
@S(s)+O2 (g)=SO2 (g) △H3=-296.8kJ·mol-1
则SO2氧化CO的热化学反应方程式__________________。
(2) CO可用于合成甲醇,反应方程式CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
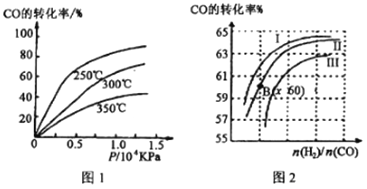
① CO转化率与温度、压强的关系如图所示,该反应△H_______0 (填“>”或“<”)
图2中曲线I、II、III对应的平衡常数分别为K1、K2、K3,则它们的大小关系为___________。测得B(x,60)点氢气的转化率为40%,则x=___________。
②一定条件下,将2molCO和2molH2置于容积为2L固定的密闭容器中发生上述反应,达到平衡时,CO与H2体积之比为2:1,则平衡常数K=___________。
(3)处理高浓度乙醛废水的原理:2CH3CHO+H2O![]() CH3CH2OH+CH3COOH。使用惰性电极电解,以一定浓度的CH3CHO –Na2SO4溶液为电解貭溶液模拟工业处理,其装置如图3所示:
CH3CH2OH+CH3COOH。使用惰性电极电解,以一定浓度的CH3CHO –Na2SO4溶液为电解貭溶液模拟工业处理,其装置如图3所示:
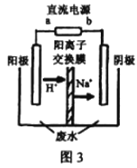
①电解过程中,两极除分别生成乙酸和乙醇外,均产生无色气体,阳极电极反应分别:4OH- -4e-=O2↑+2H2O;__________________。
②在实际处现过程中,阴极区乙醛的去除率可达60%。若在两极区分别注入lm3乙醛的含量为300mg L-1的废水,可得到乙醇_______ kg(结果保留2位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1994年度诺贝尔化学奖授予为研究臭氧作出特殊贡献的化学家。O3能吸收有害紫外线,保护人类赖以生存的空间。O3分子的结构如图,呈V型,键角116.5℃。三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键——三个O原子均等地享有这4个电子。请回答:
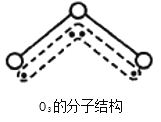
(1)选出下列分子与O3分子的结构最相似的的是___________。
A. H2O B.CO2 C.SO2 D.BeCl2
(2)分子中某原子有1对没有跟其他原子共用的价电子叫孤对电子,那么O3分子有___________对孤对电子。
(3)O3分子是_____________分子(填极性或非极性)。
(4)O3 能使淀粉碘化钾试纸变蓝2KI+O3+H2O===2KOH+I2+O2则氧化产物和还原产物的物质的量之比为____
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com