
| A. | NH3(g)+O2(g)=NO(g)+H2O(g)△H=-akJ•mol-1 | |
| B. | C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l)△H=-bkJ•mol-1 | |
| C. | 2CO(g)+O2(g)=2CO2(g)△H=-ckJ•mol-1 | |
| D. | CH3CH2OH(l)+$\frac{1}{2}$O2(g)=CH3CHO(l)+H2O(l)△H=-dkJ•mol-1 |
分析 从燃烧热的定义分析,燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物放出的热量.
解答 解:A、燃烧热要求可燃物必须生成是稳定的氧化物,即NH3(g)完全燃烧生成稳定的氧化物应为氮气和液态水,所以热化学方程式中△H不等于燃烧热,故A错误;
B、燃烧热要求可燃物的物质的量必须为1mol,得到的氧化物必须是稳定的氧化物,热化学方程式中△H代表燃烧热,故B正确;
C、热化学方程式中CO的物质的量不为1mol,热化学方程式中△H不等于燃烧热,故C错误;
D、燃烧热要求可燃物必须生成是稳定的氧化物,即CH3CH2OH(l)燃烧生成二氧化碳和液态水,所以热化学方程式中△H不等于燃烧热,故D错误.
故选B.
点评 本题考查燃烧热的定义,题目难度不大,注意燃烧热概念的理解.


科目:高中化学 来源: 题型:选择题
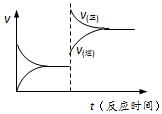 已知:
已知:| A. | 反应①使用催化剂,△H1减小 | |
| B. | 反应②生成物总能量低于反应物总能量 | |
| C. | 反应③一定能自发进行 | |
| D. | 反应③达到平衡后升高温度,v(正)、v(逆)的变化如图所示 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | E3+的氧化性比M2+的氧化性强 | |
| B. | 在反应①中硫酸既表现了酸性、又表现了氧化性 | |
| C. | 我国是世界上最早使用反应②冶炼金属M的国家 | |
| D. | 在③反应中若不加稀硫酸可能看到红褐色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ; B、C、E离子半径的由大到小的顺序为Cl->O2->Na+;(用离子符号回答) A、B气态氢化物沸点更高的是H2O;
; B、C、E离子半径的由大到小的顺序为Cl->O2->Na+;(用离子符号回答) A、B气态氢化物沸点更高的是H2O;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 25℃时,FeS和ZnS的饱和溶液中,金属阳离子与S2-的物质的量浓度的负对数关系如图所示.下列说法正确的是( )
25℃时,FeS和ZnS的饱和溶液中,金属阳离子与S2-的物质的量浓度的负对数关系如图所示.下列说法正确的是( )| A. | 溶解度S(FeS)<S(ZnS) | |
| B. | a点表示FeS的不饱和溶液,且c(Fe2+)>c(S2-) | |
| C. | 向b点对应溶液中加入Na2S溶液,可转化为c点对应的溶液 | |
| D. | 向c点对应的溶液中加入Na2S溶液,ZnS的KSP增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a、c、d均存在两种以上的氧化物 | |
| B. | b的氧化物与d的最高价氧化物对应水化物反应后的溶液呈酸性 | |
| C. | a是短周期中金属性最强的元素 | |
| D. | 工业上是通过电解b、d形成的化合物制取b单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
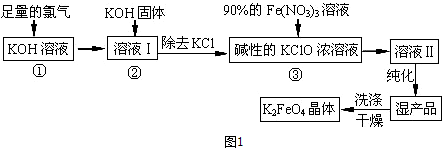
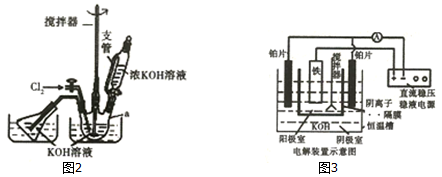
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用葡萄糖制镜或保温瓶胆 | B. | 用Na2S除去废水中的Hg2+ | ||
| C. | Na2O2作供氧剂 | D. | SO2漂白织物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com