
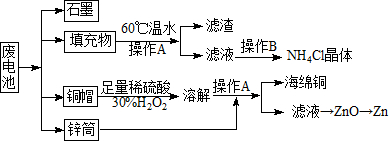
 常见锌锰干电池因含有汞、酸或碱等,废弃后进入环境将造成严重危害.某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源
常见锌锰干电池因含有汞、酸或碱等,废弃后进入环境将造成严重危害.某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源分析 废旧干电池含有铜、石墨、二氧化锰以及填充物等,填充物用60℃充分溶解,过滤,滤液中含有氯化铵,蒸发、浓缩、结晶可得到氯化铵晶体;铜与稀硫酸在过氧化氢作用发生氧化还原反应生成硫酸铜,加入锌可置换出铜,过滤分离,硫酸锌溶液最终可生成氢氧化锌、氧化锌,冶炼可得到锌,
(1)操作A用于分离固体和液体;
(2)酸性条件下,双氧水能将铜氧化生成铜离子;加热条件下,双氧水易分解;
(3)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O═2MnOOH+Zn(OH)2,其负极上锌失电子发生氧化反应;
(4)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止.其主要反应为2MnO(OH)+MnO2+2H2C2O4+3H2SO4═3MnSO4+4CO2↑+6H2O.
①根据二氧化锰和转移电子之间的关系式计算;
②MnO(OH)与浓盐酸在加热条件下也可发生反应生成氯化锰、氯气和水.
解答 解:废旧干电池含有铜、石墨、二氧化锰以及填充物等,填充物用60℃充分溶解,过滤,滤液中含有氯化铵,蒸发、浓缩、结晶可得到氯化铵晶体;铜与稀硫酸在过氧化氢作用发生氧化还原反应生成硫酸铜,加入锌可置换出铜,过滤分离,硫酸锌溶液最终可生成氢氧化锌、氧化锌,冶炼可得到锌,
(1)分离不溶性固体和溶液采用过滤的方法,所以该操作名称是过滤,故答案为:过滤;
(2)酸性条件下,双氧水能将铜氧化生成铜离子反应的化学方程式为:Cu+H2O2+H2SO4=CuSO4+2H2O;加热条件下,双氧水易分解生成水和氧气,所以除去双氧水的方法是加热,故答案为:Cu+H2O2+H2SO4=CuSO4+2H2O; 加热;
(3)负极发生氧化反应,由方程式可知Zn被氧化生成Zn(OH)2,则电极方程式为Zn+2OH--2e-=Zn(OH)2,故答案为:Zn+2OH--2e-=Zn(OH)2;
(4)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止.其主要反应为2 MnO(OH)+MnO2+2H2C2O4+3H2SO4═3MnSO4+4CO2↑+6H2O.
①该反应中,氧化剂是MnO(OH)、MnO2,还原剂是草酸,当1mol MnO2参加反应时,转移电子的物质的量=$\frac{1mol}{1}$×2×2×(4-3)=4mol,故答案为:4;
②MnO(OH)与浓盐酸在加热条件下也可发生反应生成氯化锰、氯气和水,反应方程式为:2MnO(OH)+6HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2MnCl2+Cl2↑+4H2O,
故答案为:2MnO(OH)+6HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2MnCl2+Cl2↑+4H2O.
点评 本题考查了物质的分离和提纯、原电池原理,根据原电池正负极上发生的反应、物质的性质及其分离方法来分析解答,能从整体上把握物质分离过程,熟练掌握基础知识,灵活运用知识解答,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | Ar原子的结构示意图: | |
| B. | 丙烷分子的比例模型: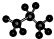 | |
| C. | NaClO的电子式: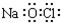 | |
| D. | HCO3-电离方程式:HCO3-+H2O?CO32-+H3O+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Fe3+、SO42-、Br- | B. | Ba2+、Na+、OH-、MnO4- | ||
| C. | H+、Na+、NO3-、Cl- | D. | Al3+、K+、HCO3-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2+ | B. | Mg2+ | C. | CO32- | D. | Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 有一种蓝色晶体[可表示为:MxFey(CN)6],经X射线研究发现,它的结构特征是Fe3+和Fe2+互相占据立方体互不相邻的顶点,而CN-位于立方体的棱上.其晶体中阴离子的最小结构单元如图所示.下列说法正确的是( )
有一种蓝色晶体[可表示为:MxFey(CN)6],经X射线研究发现,它的结构特征是Fe3+和Fe2+互相占据立方体互不相邻的顶点,而CN-位于立方体的棱上.其晶体中阴离子的最小结构单元如图所示.下列说法正确的是( )| A. | 该晶体属于分子晶体,化学式为MFe2(CN)6 | |
| B. | 该晶体属于离子晶体,M呈+1价 | |
| C. | 该晶体属于离子晶体,M呈+2价 | |
| D. | 晶体中与每个Fe3+距离最近且等距离的CN-为12个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
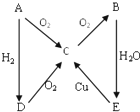 如图A→E是五种中学化学常见物质其中A、B、C、D常温下都是气体,B 为红棕色,A为气体单质.
如图A→E是五种中学化学常见物质其中A、B、C、D常温下都是气体,B 为红棕色,A为气体单质.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com