


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
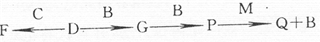
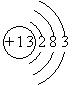

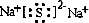
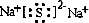


查看答案和解析>>
科目:高中化学 来源: 题型:
(08浙江省开化中学模拟)下列事实中,能证明NH3?H2O是弱电解质的是( )
A.常温时,稀氨水的导电性比稀NaOH溶液的导电性弱
B.常温时,等浓度等体积的氨水和盐酸混合,混合液pH小于7
C.1mol?L-1的氨水可以使酚酞试液变红色
D.液氨不导电
查看答案和解析>>
科目:高中化学 来源: 题型:
(08年温州市适应性测试)下列说法正确的是( )
A.常温时,NaHCO3 溶液的pH 值比同浓度的CH3COONa 溶液小
B.常温时,pH=3的硫酸与pH=11的氨水等体积混合后,溶液呈酸性
C.把FeCl 和FeCl2溶液分别蒸干并灼烧最后都得到Fe203 固体
D.以酚酞作指示剂,用相同浓度的盐酸滴定等体积等浓度的NaOH溶液和氨水,消耗盐酸的体积相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com