
【题目】化学反应前后肯定没有变化的是
①原子数 ②分子数 ③元素种类 ④物质的总质量 ⑤物质的种类 ⑥共价键数
A. ②④⑥B. ①③④C. ①③⑤D. ①③⑥
科目:高中化学 来源: 题型:
【题目】下列图象错误的是( )
|
|
A.向100mL 0.1molL﹣1H2SO4溶液中滴加 | B.向100mL 0.1molL﹣1H2SO4溶液中加入NaOH固体 |
|
|
C.向一定浓度的氯化钠溶液中加水 | D.向蒸馏水中通入HCl气体 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用H2还原WO3制备金属W的装置如图所示(Zn粒中往往含有碳等杂质,焦性没食子酸溶液用于吸收少量氧气),下列说法正确的是( )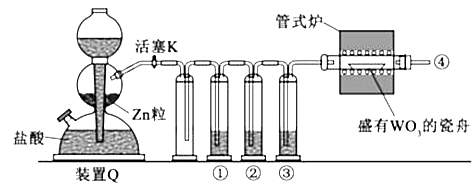
A.①、②、③中依次盛装KMNO4溶液、浓H2SO4、焦性没食子酸溶液
B.管式炉加热前,用试管在④处收集气体并点燃,通过声音判断气体浓度
C.结束反应时,先关闭活塞K,再停止加热
D.装置Q(启普发生器)也可用于二氧化锰与浓盐酸反应制备氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(15分)钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用.回答下列问题:
(1)元素K的焰色反应呈紫红色,其中紫色对应的辐射波长为nm(填标号).
A.404.4
B.553.5
C.589.2
D.670.8
E.766.5
(2)基态K原子中,核外电子占据的最高能层的符号是 , 占据该能层电子的电子云轮廓图形状为 . K和Cr属于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属Cr低,原因是 .
(3)X射线衍射测定等发现,I3AsF6中存在I3+离子.I3+离子的几何构型为 , 中心原子的杂化类型为 .
(4)KIO3晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立体结构,边长为a=0.446nm,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示.K与O间的最短距离为nm,与K紧邻的O个数为 .
(5)在KIO3晶胞结构的另一种表示中,I处于各顶角位置,则K处于位置,O处于位置.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某市医学院研发出一种新型的补铁药品.该药品的有效成分是琥珀酸亚铁(暗黄色,难溶于水,易溶于HCl).为了检测该药品中的Fe2+ , 某学习小组设计了如图实验步骤: 
(1)A溶液中溶质的化学式是 . 加入A溶液后,不等加入新制氯水就产生浅红色的原因是 . 加入新制氯水之后的变化用离子方程式表示是 , 因产生Fe3+ , 溶液变成血红色.
(2)生成的血红色溶液放置时间过长,会最终褪色.甲同学猜想是Fe3+被还原成Fe2+导致褪色.证明甲同学的猜想不合理的实验操作是取少量褪色溶液,滴加 , 观察到现象即可证明.
(3)乙同学为检测药品中Fe的含量,设计并进行了如下实验: ①取样、碾碎,精确称取2.0g,加入过量盐酸,搅拌使其完全溶解;
②向所得溶液中加入过量H2O2溶液,再加入氨水至不再产生沉淀;
③将所得固体灼烧至恒重,得到0.8g纯净的红棕色粉末.
则该药品中铁的质量分数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了提纯下列物质(括号内为杂质),所选用的除杂试剂、分离方法、必用仪器都正确的是( )
选项 | 不纯物质 | 除杂试剂 | 分离方法 | 必用仪器 |
A | 碘水 | 四氯化碳 | 萃取 | 分液漏斗 |
B | 氯化钾(氯化钙) | 适量盐酸 | 过滤 | 玻璃棒 |
C | 硝酸铜(硝酸银) | 适量铜粉 | 结晶 | 酒精灯 |
D | 硫酸钾(碳酸钾) | 适量盐酸 | 蒸馏 | 温度计 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实与氢键无关的是( )
A. NH3分子极易溶于水B. 水结成冰体积膨胀,密度变小
C. 水加热到很高的温度都难以分解D. 水的沸点比H2S的沸点高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物.下列说法正确的是( ) 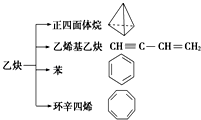
A.正四面体烷的分子式为C4H4 , 其二氯代物有两种
B.等质量的乙炔与乙烯基乙炔完全燃烧时的耗氧量相同
C.苯为平面六边形结构,分子中存在C﹣C和C═C,能使酸性KMnO4溶液褪色
D.环辛四烯跟苯的结构很像,不能使溴水褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙可以用于改善地表水质,处理含重金属粒子废水和治理赤潮,也可用于应急供氧等.工业上生产过氧化钙的主要流程如下: 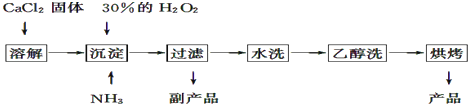
已知CaO28H2O呈白色,微溶于水,不溶于醇类和乙醚等,加热至350℃左右开始分解放出氧气.
(1)用上述方法制取CaO28H2O的化学方程式是;
(2)该制法的副产品为(填化学式),为了提高副产品的产率,结晶前要将溶液的pH调整到合适范围,可加入的试剂是;
(3)检验“水洗”是否合格的方法是;
(4)测定产品中CaO2的含量的实验步骤:
第一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入适量2molL﹣1的盐酸溶液,充分反应.
第二步:向上述锥形瓶中加入几滴淀粉溶液.
第三步:逐滴加入浓度为c molL﹣1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL.
已知:I2+2S2O32﹣═2I﹣+S4O62﹣
①第一步反应的离子方程式为;
②第三步中盛放Na2S2O3溶液的仪器名称是 , 反应完全时的现象为
③产品中CaO2的质量分数为(用字母表示).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com