
| A. | 60 mL 1 mol•L-1的氯化钠溶液 | B. | 30 mL 2 mol•L-1的氯化铵溶液 | ||
| C. | 60 mL 3 mol•L-1的氯化钾溶液 | D. | 30 mL 1 mol•L-1的氯化铁溶液 |
分析 电解质离子的物质的量浓度=溶质的物质的量浓度×溶质化学式中含有离子的个数,与溶液的体积无关.
解答 解:20mL 1mol•L-1的AlCl3溶液中氯离子的物质的量浓度为1mol•L-1×3=3mol•L-1.
A.60mL 1mol•L-1的KCl溶液中氯离子的物质的量浓度为1mol•L-1×1=1mol•L-1,故A错误;
B.30mL 2mol•L-1的NH4Cl溶液中氯离子的物质的量浓度为2mol•L-1×1=2mol•L-1,故B错误;
C.60mL 1mol•L-1的KCl溶液中氯离子的物质的量浓度为1mol•L-1×1=1mol•L-1,故C错误;
D.30mL 1mol•L-1的FeCl3溶液中氯离子的物质的量浓度为1mol•L-1×3=3mol•L-1,故D正确;
故选:D.
点评 本题考查物质的量浓度的计算与理解,题目难度不大,注意溶液中溶质离子的浓度与溶液体积无关,只取决于物质电离出的离子的数目多少与溶质的浓度.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | CH3COONa | B. | NH3•H2O | C. | HCl | D. | H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
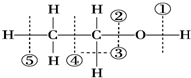
| A. | 与醋酸、浓硫酸共热时,②键断裂 | B. | 与金属钠反应时,①键断裂 | ||
| C. | 与浓硫酸共热至170℃时,②⑤键断裂 | D. | 在银催化下与O2反应时,①③键断裂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)+c(H+)=c(X-)+c(OH-) | |
| B. | 若混合液呈酸性,则c(X-)>c(Na+)>c(HX)>c(H+)>c(OH-) | |
| C. | c(HX)+c(X-)=2c(Na+) | |
| D. | 若混合液呈碱性,则c(Na+)>c(HX)>c(X-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分散质直径介于1 nm-100 nm之间的分散系称为胶体 | |
| B. | Fe(OH)3难溶于水,因此不可能均匀分散在水里形成稳定的红褐色的液体 | |
| C. | 氢氧化铁胶体粒子在电泳实验中向阴极移动,是因为氢氧化铁胶体粒子带负电 | |
| D. | 胶体粒子是很多分子的集合体,因此都很不稳定,容易聚沉 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 有关问题 |
| ①计算所需Na2SO4的质量 | 需要称量Na2SO4的质量为14.2克 |
| ②称量Na2SO4固体 | 称量需要用到的主要仪器是:托盘天平和药匙 |
| ③将Na2SO4加入100mL烧杯中,并加入适量水 | 为了加快溶解速率,可以采取哪些措施: 用玻璃棒搅拌 |
| ④将烧杯中溶液转移至500mL容量瓶中 | 为了防止溶液溅出,应采取什么措施: 转移过程中用玻棒进行引流 |
| ⑤向容量瓶中加蒸馏水至刻度线 | 在进行此操作时当加水至刻度线1-2厘米处应如何操作: 改用胶头滴管加水至凹液面与刻度线相切 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 编号 | 实验温度 /℃ | Na2S2O3 | H2SO4 | 蒸馏水体积 /mL | ||
| 体积/mL | 浓度/mol•L-1 | 体积/mL | 浓度/mol•L-1 | |||
| ① | 25 | 10 | 0.1 | 10 | 0.1 | 0 |
| ② | 25 | 5 | 0.1 | 10 | 0.1 | 5 |
| ③ | 25 | 5 | 0.2 | 10 | 0.2 | 5 |
| ④ | 50 | 5 | 0.1 | 10 | 0.1 | 5 |
| ⑤ | 50 | 10 | 0.2 | 5 | 0.2 | 5 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com