
【题目】老北京传统小吃历史悠久,是北京独树一帜的文化符号,门钉肉饼是其中之一。制作门钉肉饼的部分原料如下:①牛肉②面粉③盐④花生油。请回答:
(1)富含油脂的是______(填序号,下同)。
(2)富含淀粉的是______。
(3)富含蛋白质的是______。
(4)属于调味剂的是______。
科目:高中化学 来源: 题型:
【题目】氨氧燃料电池具有很大的发展潜力,其工作原理如图所示。下列有关该电池的说法错误的是
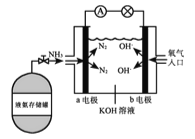
A.该电池工作时,溶液的pH不变
B.a电极为负极,b电极为正极
C.电子从a电极流出,经过导线到达b电极
D.电池总反应为4NH3+3O2=2N2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将50 mL 0.1 mol·L-1的NaCl溶液和50 mL 0.5 mol·L-1的CaCl2溶液混合后,若溶液的体积为二者体积之和,则混合溶液中c(Cl-)为
A.2 mol·L-1 B.1 mol·L-1
C.0.67 mol·L-1 D.0.55 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学兴趣小组的同学为测定某Na2CO3和NaCl的固体混合物样品中Na2CO3的质量分数进行了以下实验,请你参与并完成对有关问题的解答。

(1)甲同学用上图所示装置测定CO2的质量。实验时稀硫酸是与样品中的_________(填“Na2CO3”或
"NaCl”)发生反应。仪器b的名称是_____________。洗气瓶c中盛装的是浓硫酸,此浓硫酸的作用是____________。
(2)乙同学用下图所示方法和步骤实验:

①操作I涉及的实验名称有__________、洗涤;操作Ⅱ涉及的实验名称有干燥、___________。
②乙测得的样品中Na2CO3质量分数的计算式为___________________。
(3)标准状况下,将672 mL CO2气通入50 mL1mol/LKOH溶液中,完全反应后,所得溶液中K2CO3和KHCO3的物质的量之比为(设反应前后溶液体积变化忽略不计)____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨、烧碱在工农业生产和工业废水处理中具有广泛用途。回答下列问题:
(1)工业上制取硝酸的第一步是以氨和空气为原料,用铂一铑合金网为催化剂,在氧化炉中(温度为800℃)进行氨催化氧化反应。该反应的氧化产物为____________(填名称)。
(2)某工业废水中含有2Mg2+、Cu2+等离子。取一定量的该工业废水,向其中滴加烧碱溶液,当Mg(OH)2开始沉淀时,溶液中![]() 为____________。已知Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20
为____________。已知Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20
(3)已知反应N2(g)+3H2(g)![]() 2NH3(g)的△H=-92.2kJ/mol,1molN2(g),1molH2(g)分子中化学键断裂时分别需要吸收944.6KJ、436KJ的能量,则1molNH3(g)分子中化学键断裂时需吸收的能量为__________KJ。
2NH3(g)的△H=-92.2kJ/mol,1molN2(g),1molH2(g)分子中化学键断裂时分别需要吸收944.6KJ、436KJ的能量,则1molNH3(g)分子中化学键断裂时需吸收的能量为__________KJ。
(4)Fritz Haber 研究了下列反应:N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
在500℃、20MPa时,将N2和H2通入到体积为2L的密闭容器中,反应过程中各种物质的物质的量变化如右图所示:

①在0~10min内,平均反应速率v(NH3)= ___________。
②在10~20min内,各物质浓度变化的原因可能是_________(填“加了催化剂”或“降低温度”),其判断理由是________________。
③温度和密闭容器的容积一定时,当容器内的总压强不再随时间而变化,反应是否达到了化学平衡状态?___________(填“是”或“否”)其判断理由是_________________。
④500℃时,该反应的平衡常数K的计算式为_________(不需要算出结果,) NH3的体积分数是_________(保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值。下列说法中正确的是
①常温下,0.1molCl2与足量NaOH溶液反应,转移的电子数目为0.2NA
②常温常压下,18gH2O中含有的电子总数为10NA
③将100 mL 0.1 mol·L-1FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒0.01NA
④在反应KIO3+6HI==KI+3I2+3H2O中,每生成3 mol I2转移的电子数为5NA
⑤常温常压下,14g的C2H4和C4H8混合气体中含有的原子数为3NA
⑥在标准状况下,0.5molNO与0.5molO2混合后气体分子数为0.75 NA
⑦1.0L 1.0 mol·L-1 Na2SiO3水溶液中含有的氧原子数为3NA
A.①⑤⑦ B.③④⑥
C.②④⑤ D.②③⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通过电解MnSO4和ZnSO4制取Zn和MnO2,原料为软锰矿和闪锌矿,软锰矿中含MnO2约a%,SiO2约20%,Al2O3约4%,其余为水分,闪锌矿中含ZnS约80%,FeS、CuS、SiO2共约7%,其余为水分。
I.(1)为了测量软锰矿中MnO2含量的测定,现将14. 5g软锰矿溶于足量的稀硫酸中,加入足量的碘化钾晶体,充分反应后,过滤,将滤液加水稀释至1L,取25.00ml该溶液于锥形瓶中,滴入几滴淀粉溶液作指示剂,用0. l000mol.L-1的标准Na2S2O3溶液滴定,消耗标准液50. 00mL,则软锰矿中MnO2含量_________。(己知:2KI+2 H2SO4+ MnO2=I2+2H2O+MnSO4+K2SO4;I2+2 S2O32-=2I-+ S4O62-)
II.研宄人员开发了综合利用这两种资源的同槽酸浸工艺,工艺流程如图l所示.

请回答下列问题:
(2)反应I的滤液中含有MnSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al2 (SO4)3等,试完成反应I中生成CuSO4和MnSO4的化学方程MnO2+CuS+___________=________+_________+CuSO4+MnSO4.
(3)反应II加入适量锌的作用是___________;如果锌过量,还会进一步发生反应的离子方程式为_____________。
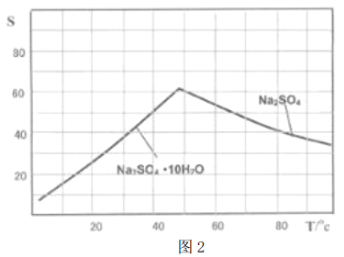
(4)图2是Na2SO4和Na2SO4·10H2O的溶解度曲线(g/l00g水),则Ⅳ中得到Na2SO4固体的操作是:将分离出MnCO3和ZnCO3后的滤液升温结晶→___________→用乙醇洗涤→干燥,用乙醇洗涤而不用水洗的原因是__________________________。
(5)用惰性电极电解MnSO4和ZnSO4制得Zn和MnO2的总反应是_______________________。
(6)本工艺可以循环利用的物质除MnO2、MnCO3、ZnCO3以外,还有___________(写化学式).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液能溶解Al(OH)3,则此溶液中可能大量共存的离子组是( )
A.Fe3+、NH4+、SCN-、Cl- B. K+、Na+、SO42-、HCO3-
C.Na+、Ba2+、Cl-、NO3- D. A13+、Na+、A1O2-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器的名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置.

(1)写出下列仪器的名称:① ②
(2)仪器①~④中,使用时必须检查是否漏水的有 .(填序号)
(3)若利用装置I分离丙三醇(能跟水、酒精以任意比互溶,沸点290℃)和酒精(沸点78.2℃)的混合物,还缺少的仪器有 ,将仪器补充完整后进行的实验操作的名称为; .进水方向是 (填g或f),还需加入少量碎瓷片,其作用是 .
(4)如图所示装置Ⅱ是转移操作,请指出该操作错误之处:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com