

分析 碳酸钠溶液为碱性溶液,能够除去油污,实验步骤①的目的是洗油污,铁屑溶于稀硫酸温度控制在50~800C,加快反应速率、增大FeSO4的溶解度,由工艺流程可知,操作I是将固体与液体分离,应采取过量的方法,加入稍过量的碳酸氢铵,滤液中含Fe2+,与碳酸氢铵反应Fe2++2HCO3-=FeCO3↓+CO2↑+H2O,生成碳酸亚铁沉淀,操作II为洗涤,然后干燥、灼烧得到氧化铁,
(1)①分离可溶物和不溶物用过滤,除去固体上的少量可溶性杂质用洗涤;
②FeCO3与氧气反应生成三氧化二铁和二氧化碳;
③依据煅烧反应不完全,生成氧化铁中含有碳酸亚铁,可以先加酸溶解,再加入高锰酸钾溶液检验亚铁离子的存在;
(2)①高锰酸钾溶液具有强氧化性,亚铁离子具有还原性,酸性溶液中亚铁离子被高锰酸钾氧化为铁离子,本身被还原为锰离子,结合电荷守恒,原子守恒配平书写;
②依据元素守恒和氧化还原反应计算得到;
③亚铁离子被氧化为三价铁离子,高锰酸钾溶液做指示剂,滴定终点时溶液由浅绿色变为紫红色,且半分钟内不立即褪去;
④依据滴定过程中C(待测)=$\frac{C(标准)V(标准)}{V(待测)}$,操作过程中引起误差需要分析道到标准液的体积变化分析;
解答 解:(1)①分离可溶物和不溶物用过滤,除去固体上的少量可溶性杂质用洗涤,
故答案为:过滤;洗涤;
②在空气中煅烧FeCO3,FeCO3与氧气反应生成三氧化二铁和二氧化碳,反应方程式为4FeCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2,
故答案为:4FeCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2;
③煅烧如果不充分,产品中将有Fe2+ 存在,主要是Fe2O3和FeCO3,取样品放入试管中,加入稀硫酸溶解得到溶液,滴入高猛酸钾溶液,若滴入的高锰酸钾溶液褪色证明含有亚铁离子,否则不存在,
故答案为:取固体样品少许放入试管中,加入足量稀硫酸,震荡试管,再加入几滴滴入KMnO4溶液,若溶液褪色证明含有Fe2+,否则不存在;
(2)①高锰酸钾溶液具有强氧化性,亚铁离子具有还原性,酸性溶液中亚铁离子被高锰酸钾氧化为铁离子,本身被还原为锰离子,酸性KMnO4溶液与FeSO4溶液反应的离子方程式:MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O,
故答案为:MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O;
②依据步骤分析,25ml溶液被高锰酸钾溶液滴定反应,终点时消耗亚铁离子物质的量为:
MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O;
1 5
0.0200L×0.0100mol/L n(Fe2+)
n(Fe2+)=0.00100mol;
配制的250ml溶液中含亚铁离子物质的量n=0.01mol;
样品中绿矾的质量分数=$\frac{0.01mol×278g/mol}{2.850}$×100%=97.5%
故答案为:97.5%;
③滴定实验是利用高锰酸钾溶液的颜色变化指示反应终点,所以反应完全后,溶液呈紫红色,
故答案为:溶液由浅绿色变为紫红色,且半分钟内不立即褪去;
④滴定过程中C(待测)=$\frac{C(标准)V(标准)}{V(待测)}$,
a、锥形瓶未干燥对滴定结果无影响,故a不选;
b、盛装标准液的滴定管没有用标准液润洗,高锰酸钾溶液变稀,滴定时消耗溶液体积增大,根据C(待测)=$\frac{C(标准)V(标准)}{V(待测)}$,V标偏大,则c待偏高,故b选;
c、滴定结束时仰视刻度线读数,读出的消耗的高锰酸钾溶液体积偏大,根据C(待测)=$\frac{C(标准)V(标准)}{V(待测)}$,V标偏大,则c待偏高,故c选;
d、量取待测液的滴定管没有润洗,待测液体被稀释,则消耗的标准液体积偏小,根据C(待测)=$\frac{C(标准)V(标准)}{V(待测)}$,V标偏小,则c待偏低,故d不选;
故选bc.
点评 本题考查了铁及其化合物性质的分析应用,滴定实验的操作步骤和注意问题,滴定实验的计算应用,误差分析依据,题目难度中等.


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原氨水的浓度为10-3 mol•L-1 | |
| B. | 溶液中$\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$增大 | |
| C. | 氨水的电离程度增大,溶液中所有离子的浓度均减小 | |
| D. | 再加入10 mL pH=3的盐酸充分反应后混合液的pH值肯定等于7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
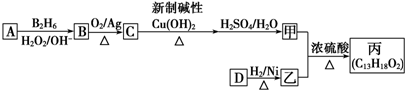
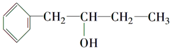 的同系物.
的同系物. .
. ,该反应的类型是取代反应.
,该反应的类型是取代反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
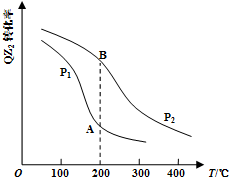 X、Y、Z、J、Q、W六种元素,原子序数依次增大,其中X、Y、Z、J、Q是短周期主族元素.元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3:8,X能与J形成离子化合物,且J+的半径大于X-的半径,Y的氧化物是形成酸雨的主要物质之一.W是应用最广泛的金属元素.请回答:
X、Y、Z、J、Q、W六种元素,原子序数依次增大,其中X、Y、Z、J、Q是短周期主族元素.元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3:8,X能与J形成离子化合物,且J+的半径大于X-的半径,Y的氧化物是形成酸雨的主要物质之一.W是应用最广泛的金属元素.请回答: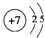 .
.| 气体 | QZ2 | Z2 | QZ3 |
| 浓度(mol/L) | 0.4 | 1.2 | 1.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在水中溶解性:Na2CO3>NaHCO3 | |
| B. | 热稳定性:Na2CO3<NaHCO3 | |
| C. | 与相同浓度的盐酸反应的速度:Na2CO3>NaHCO3 | |
| D. | Na2CO3与NaHCO3相互转化的反应是可逆反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①和② | B. | ②和③ | C. | 只有④ | D. | 只有③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体的分散质能通过滤纸空隙,而浊液的分散质不能 | |
| B. | 胶体粒子带电荷 | |
| C. | 分散质粒子直径在1 nm~100 nm之间 | |
| D. | 产生丁达尔效应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com