
| A. | 砹化氢(HAt)很稳定 | B. | 单质砹易溶于某些有机溶剂 | ||
| C. | 砹的原子半径比碘的原子半径大 | D. | 单质砹是有色固体 |
分析 砹是原子序数最大的卤族元素,利用ⅤⅡA元素性质的相似性和递变性来分析,
A.同主族从上到下非金属性减弱,气态氢化物稳定性减弱;
B.同主族元素单质的性质相似;
C.同主族从上到下原子半径逐渐增大;
D.同主族从上到下元素的单质从气态、液态、固态变化,且颜色加深.
解答 解:A.同主族从上到下元素非金属性逐渐减弱,对应的氢化物也在减弱,所以HAt很不稳定,故A选;
B.碘易溶于有机溶剂,同主族元素单质的性质相似,则砹易溶于某些有机溶剂,故B不选;
C.同主族从上到下原子半径逐渐增大,所以砹的原子半径比碘的原子半径大,故C不选;
D.同主族从上到下元素的单质从气态、液态、固态变化,且颜色加深,则砹是有色固体,故D不选;
故选A.
点评 本题考查原子结构与元素周期律的应用,题目难度不大,注意元素性质的相似性和递变性,明确元素周期律的内容为解答关键,试题培养了学生的灵活应用能力.


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液 | |
| B. | 往Fe(OH)3胶体中逐滴加入稀H2SO4时,开始时会出现沉淀,再继续滴加时,沉淀又会消失 | |
| C. | Fe(OH)3胶体粒子在电场影响下将向阴极运动,说明Fe(OH)3胶体带正电 | |
| D. | 分离胶体和某盐溶液,可用过滤的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①②④ | C. | ①② | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
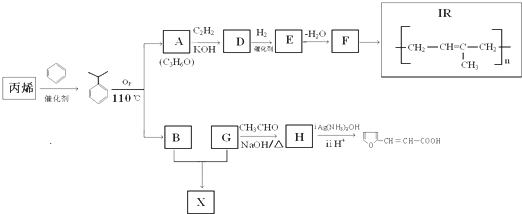
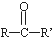 $\stackrel{KOH}{→}$
$\stackrel{KOH}{→}$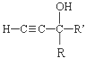
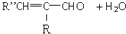 +H2O(-R、-R′、-R″表示可能相同或可能不同的原子或原子团)
+H2O(-R、-R′、-R″表示可能相同或可能不同的原子或原子团) ,反应类型是加成反应.
,反应类型是加成反应. .
. .
. .
.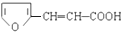 ,符合下列要求的有12种.
,符合下列要求的有12种.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
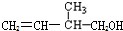 ,下列关于该有机物的叙述不正确的是( )
,下列关于该有机物的叙述不正确的是( )| A. | 能与金属钠发生反应并放出氢气 | |
| B. | 此有机物中有三种官能团:碳碳双键、羟基、甲基 | |
| C. | 能在催化剂作用下与H2发生加成反应 | |
| D. | 在浓H2SO4催化下能与乙酸发生酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | a+n=b-m | B. | X的氢化物化学式为HnX或XHn | ||
| C. | a<b | D. | Y的氧化物化学式为YOm |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
| 容器 | 甲 | 乙 | 丙 | |
| 反应物投入量 | 1mol CO、2mol H2 | 1mo l CH3OH | 2mol CH3OH | |
| 平衡时数据 | CH3OH的 浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | a kJ | b kJ | c kJ | |
| 体系压强(Pa) | p1 | p2 | p3 | |
| 反应物转化率 | α1 | α2 | α3 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com