
某学习小组设计以下实验,探究化学反应
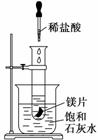
中的热效应,把试管放入盛有25℃的饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管往其中滴加5 mL盐酸。试回答下列问题:
实验中观察到的现象是________________________________________________
________________________________________________________________________
________________________________________________________________________。
(2)产生上述现象的原因是_________________________________________________。
(3)写出有关反应的离子方程式:___________________________________________。
(4)由实验推知,MgCl2和H2的总能量______(填“大于”、“小于”或“等于”)镁片和盐酸的总能量。
(5)如果将本题中“25℃的饱和石灰水”换成“20℃碳酸饮料”进行实验探究,实验中观察到的另一现象是______________________________________________________
________________________________________________________________________
______________________,其原因是____________________________________
________________________________________________________________________。
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
已知Fe3+和I-在水溶液中的反应如下:2I-+2Fe3+====I2+2Fe2+。某温度下该反应的正反应速率和I-、Fe3+浓度的关系为v=kcm(I-)·
cn(Fe3+)(k为常数)。
|
| c(I-)/mol·L-1 | c(Fe3+)/mol·L-1 | v/mol·L-1·s-1 |
| ① | 0.20 | 0.80 | 0.032 k |
| ② | 0.60 | 0.40 | 0.144 k |
| ③ | 0.80 | 0.20 | 0.128 k |
由此推知,有关Fe3+、I-的浓度对反应速率影响的判断正确的是( )
A.Fe3+浓度对正反应速率影响程度大于I-浓度的影响程度
B.Fe3+浓度对正反应速率影响程度小于I-浓度的影响程度
C.Fe3+浓度对正反应速率影响程度等于I-浓度的影响程度
D.无法比较
查看答案和解析>>
科目:高中化学 来源: 题型:
把煤作为燃料可通过下列两种途径:
途径Ⅰ C(s)+O2(g)====CO2(g) ΔH1<0
途径Ⅱ 先制水煤气:
C(s)+H2O(g)====CO(g)+H2(g) ΔH2>0
再燃烧水煤气:
2CO(g)+O2(g)====2CO2(g) ΔH3<0
2H2(g)+O2(g)====2H2O(g) ΔH4<0
请回答下列问题:
(1)判断两种途径放热:途径Ⅰ放出的热量______途径Ⅱ放出的热量(填“大于”“等于”或“小于”)。
(2)ΔH1、ΔH2、ΔH3、ΔH4的数学关系是________________________。
(3)由于制取水煤气的反应里,反应物具有的总能量_______(填“大于”“等于”或“小于”)生成物具有的总能量,那么在化学反应时,反应物就需要_______能量才能转化为生成物,因此其反应条件为_________________。
(4)已知:Fe2O3(s)+3CO(g)====2Fe(s)+3CO2(g)
ΔH1=-25 kJ·mol-1①
3Fe2O3(s)+CO(g)====2Fe3O4(s)+CO2(g)
ΔH2=-47 kJ·mol-1②
Fe3O4(s)+CO(g)====3FeO(s)+CO2(g)
ΔH3=+19 kJ·mol-1③
请写出CO还原FeO的热化学方程式:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下表回答问题:
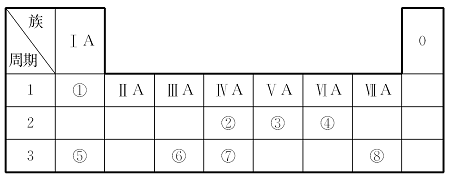
(1)元素⑦在周期表中的位置是___________________。
(2)元素①和⑤的原子序数相差 。
(3)写出元素⑤形成的常见化合物与元素⑧形成的单质反应的化学方程式____
__________________________。
(4)写出元素③形成的不同化合价的化合物的化学式(写出四个)____________
___________________________________________________________________,
其中能与元素⑥形成的单质反应的化学方程式为_________________________
__________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.化学反应中的能量变化,都表示为热量的变化
B.需要加热才能发生的化学反应,一定是吸热反应
C.放热反应在常温下一定很容易发生
D.反应是放热还是吸热必须看反应物和生成物所具有的总能量的相对大小
查看答案和解析>>
科目:高中化学 来源: 题型:
热化学方程式C(s)+H2O(g)===CO(g)+H2(g) ΔH=131.3 kJ·mol-1表示( )
A.碳和水反应吸收131.3 kJ能量
B.1 mol碳和1 mol水反应生成1 mol一氧化碳和1 mol氢气并吸收131.3 kJ热量
C.1 mol固态碳和1 mol水蒸气反应生成1 mol一氧化碳气体和1 mol氢气并吸收131.3 kJ热量
D.1个固态碳原子和1分子水蒸气反应吸热131.3 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
已知298 K时,合成氨反应N2(g)+3H2(g)===2NH3(g) ΔH=-92.0 kJ·mol-1,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应。测得反应放出的热量为(假定测量过程中没有能量损失)( )
A.一定小于92.0 Kj B.一定大于92.0 kJ
C.一定等于92.0 kJ D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
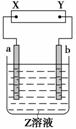
如图所示,X、Y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色、无味气体放出。符合这一情况的是附表中的( )
| a极板 | b极板 | X电极 | Z溶液 | |
| A | 锌 | 石墨 | 负极 | CuSO4 |
| B | 石墨 | 石墨 | 负极 | NaOH |
| C | 银 | 铁 | 正极 | AgNO3 |
| D | 铜 | 石墨 | 负极 | CuCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于资源综合利用和环境保护的化学方程式不正确的是( )
A.海水提取溴时用SO2吸收溴蒸气:Br2+SO2+2H2O====H2SO4+2HBr
B.将煤气化为可燃性气体:C(s)+H2O(g) CO(g)+H2(g)
CO(g)+H2(g)
C.用过量NaOH溶液吸收SO2:SO2+NaOH====NaHSO3
D.燃烧煤时加入CaCO3脱硫:2CaCO3+O2+2SO2 2CaSO4+2CO2
2CaSO4+2CO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com