
 已知硫酸、氨水的密度与所加水的量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
已知硫酸、氨水的密度与所加水的量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:| 溶质的物质的量浓度/mol?L-1 | 溶液的密度/g?cm-3 | |
| 硫酸 | c1 | ρ1 |
| 氨水 | c2 | ρ2 |
 c2mol?L-1的氨水等质量混合,所得溶液的密度______(填“大于”、“小于”或“等于”,下同) ρ2g?cm-3所得溶液的物质的量浓度______
c2mol?L-1的氨水等质量混合,所得溶液的密度______(填“大于”、“小于”或“等于”,下同) ρ2g?cm-3所得溶液的物质的量浓度______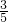 c2mol?L-1(设混合后溶液的体积变化忽略不计).
c2mol?L-1(设混合后溶液的体积变化忽略不计). 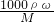 进行公式可知,硫酸的质量分数ω=
进行公式可知,硫酸的质量分数ω=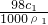 ,故答案为:
,故答案为: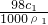 ;
;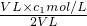 =0.5c1mol/L,故答案为:0.5c1;
=0.5c1mol/L,故答案为:0.5c1; c2 mol?L-1的氨水等质量混合,混合后溶液的浓度小于c2 mol?L-1的氨水,由图可知,氨水的浓度越大密度越小,故混合后溶液的密度大于ρ2 g?cm-3,
c2 mol?L-1的氨水等质量混合,混合后溶液的浓度小于c2 mol?L-1的氨水,由图可知,氨水的浓度越大密度越小,故混合后溶液的密度大于ρ2 g?cm-3, c2 mol?L-1的氨水等质量混合,令c2 mol?L-1和
c2 mol?L-1的氨水等质量混合,令c2 mol?L-1和 c2 mol?L-1的氨水的体积分别为aL、bL,混合后溶液的体积为(a+b)L,混合后硫酸的物质的量浓度为
c2 mol?L-1的氨水的体积分别为aL、bL,混合后溶液的体积为(a+b)L,混合后硫酸的物质的量浓度为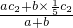 =c2-
=c2-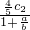 ,氨水的浓度越大密度越小,根据V=
,氨水的浓度越大密度越小,根据V=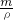 可知a>b,故
可知a>b,故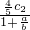 <
<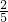 c2,故c2-
c2,故c2-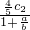 >
>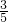 c2,
c2,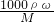 进行公式变形计算;
进行公式变形计算; c2 mol?L-1的氨水等质量混合,混合后溶液的浓度小于c2 mol?L-1的氨水,由图可知,氨水的浓度越大密度越小,据此判断混合后溶液的密度与ρ2 g?cm-3关系;
c2 mol?L-1的氨水等质量混合,混合后溶液的浓度小于c2 mol?L-1的氨水,由图可知,氨水的浓度越大密度越小,据此判断混合后溶液的密度与ρ2 g?cm-3关系; c2 mol?L-1的氨水等质量混合,令c2 mol?L-1和
c2 mol?L-1的氨水等质量混合,令c2 mol?L-1和 c2 mol?L-1的氨水的体积分别为aL、bL,混合后溶液的体积为(a+b)L,表示出混合后硫酸的物质的量浓度,氨水的浓度越大密度越小,根据V=
c2 mol?L-1的氨水的体积分别为aL、bL,混合后溶液的体积为(a+b)L,表示出混合后硫酸的物质的量浓度,氨水的浓度越大密度越小,根据V=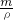 可知a>b,据此判断.
可知a>b,据此判断.

科目:高中化学 来源: 题型:阅读理解
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
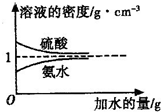 已知硫酸、氨水的密度与所加水的量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
已知硫酸、氨水的密度与所加水的量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:| 溶质的物质的量浓度/mol?L-1 | 溶液的密度/g?cm-3 | |
| 硫酸 | c1 | ρ1 |
| 氨水 | c2 | ρ2 |
| 1 |
| 5 |
| 3 |
| 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
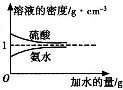 已知硫酸、氨水的密度与所加水的量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
已知硫酸、氨水的密度与所加水的量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:| 溶质的物质的量浓度/mol?L-1 | 溶液的密度/g?cm-3 | |
| 硫酸 | c1 | ρ1 |
| 氨水 | c2 | ρ2 |
| 1 |
| 5 |
| 3 |
| 5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com