
| CO浓度(mol•L-1) | H2浓度(mol•L-1) | 逆反应速率(mol•L-1•min-1) |
| 0.1 | c1 | 9.6 |
| c2 | c1 | 19.2 |
| c2 | 0.3 | 64.8 |
分析 (1)C(s)+2H2(g)?CH4(g)△H=-73kJ•mol-1①
2CO(g)?C(s)+CO2(g)△H=-171kJ•mol-1②
CO(g)+3H2(g)?CH4(g)+H2O(g)△H=-203kJ•mol-1③
将方程式①+②-③得CO(g)+H2O(g)=H2(g)+CO2(g),焓变进行相应的改变;
(2)根据电离平衡常数知,一水合氨电离程度大于硫化氢电离程度,所以NH4HS溶液铵根离子水解程度小于HS-水解程度,溶液呈碱性,则[OH-]>[H+],但铵根离子和硫化氢离子水解程度都较小;硫氢根离子水解程度大于其电离程度;
(3)①$\frac{19.2}{9.6}$=2=$\frac{k{c}_{2}({c}_{1})^{3}}{k×0.1×({c}_{1})^{3}}$,c2=0.2,64.8=k(c2).(0.3)3=k×0.2×(0.3)3,据此计算k值;
②相同温度下,增大压强平衡逆向移动,则氢气体积分数降低;同一压强下,升高温度平衡向吸热方向移动,根据温度与氢气体积分数关系确定反应热;
③N点时要使反应达到平衡状态,反应应该向正反应方向移动;
设参加反应的甲烷物质的量浓度为xmol/L
该反应CH4(g)+H2O(g)═CO(g)+3H2(g)
开始(mol/L)1 1 0 0
反应(mol/L)x x x 3x
平衡(mol/L)1-x 1-x x 3x
化学平衡常数只与温度有关,温度不变化学平衡常数不变,达到平衡状态时氢气体积分数为60%,
则$\frac{3x}{1-x+1-x+x+3x}$×100%=60%,x=$\frac{2}{3}$,
化学平衡常数K=$\frac{x.(3x)^{3}}{(1-x)^{2}}$.
解答 解:(1)C(s)+2H2(g)?CH4(g)△H=-73kJ•mol-1 ①
2CO(g)?C(s)+CO2(g)△H=-171kJ•mol-1 ②
CO(g)+3H2(g)?CH4(g)+H2O(g)△H=-203kJ•mol-1 ③
将方程式①+②-③得CO(g)+H2O(g)=H2(g)+CO2(g),△H=(-73kJ•mol-1 )+(-171kJ•mol-1)-(-203kJ•mol-1 )=-41kJ/mol,
故答案为:CO(g)+H2O(g)=H2(g)+CO2(g),△H=-41kJ/mol;
(2)根据电离平衡常数知,一水合氨电离程度大于硫化氢电离程度,所以NH4HS溶液铵根离子水解程度小于HS-水解程度,溶液呈碱性,则[OH-]>[H+],但铵根离子和硫化氢离子水解程度都较小,所以离子浓度大小顺序是[NH4+]>[HS-]>[OH-]>[H+],硫氢根离子水解程度大于其电离程度,所以还存在:[NH4+]>[HS-]>[H2S]>[H+],
故选ac;
(3)①$\frac{19.2}{9.6}$=2=$\frac{k{c}_{2}({c}_{1})^{3}}{k×0.1×({c}_{1})^{3}}$,c2=0.2,64.8=k(c2).(0.3)3=k×0.2×(0.3)3,k=1.2×104 ,
故答案为:1.2×104;
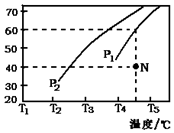
②相同温度下,增大压强平衡逆向移动,则氢气体积分数降低,根据图知,P1条件下氢气体积分数小于P2条件下的氢气体积分数,则P1 大于P2;同一压强下,升高温度平衡向吸热方向移动,该反应的正反应是吸热反应,升高温度氢气体积分数增大,则T3 小于T4,
故答案为:大于;小于;
③N点时要使反应达到平衡状态,反应应该向正反应方向移动,则v正大于v逆;
设参加反应的甲烷物质的量浓度为xmol/L
该反应CH4(g)+H2O(g)═CO(g)+3H2(g)
开始(mol/L)1 1 0 0
反应(mol/L)x x x 3x
平衡(mol/L)1-x 1-x x 3x
化学平衡常数只与温度有关,温度不变化学平衡常数不变,达到平衡状态时氢气体积分数为60%,
则$\frac{3x}{1-x+1-x+x+3x}$×100%=60%,x=$\frac{2}{3}$,
化学平衡常数K=$\frac{x.(3x)^{3}}{(1-x)^{2}}$=$\frac{\frac{2}{3}.(3×\frac{2}{3})^{3}}{(1-\frac{2}{3})^{2}}$=48,
故答案为:大于;48.
点评 本题考查盖斯定律、盐类水解、化学平衡计算,为高频考点,侧重考查学生分析判断及计算能力,明确电离平衡常数与离子水解程度关系、三段式在化学平衡计算中的灵活运用是解本题关键,注意(3)不能根据N点浓度计算其化学平衡常数,应该用平衡时各物质浓度计算化学平衡常数,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | BaSO4的溶解度增大,Ksp不变 | B. | BaSO4的溶解度、Ksp均增大 | ||
| C. | BaSO4的溶解度、Ksp均不变 | D. | BaSO4的溶解度不变,Ksp增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 0min | 5min | 10min | |
| CO | 0.01 | 0.0056 | |
| H2O | 0.01 | 0.0156 | |
| CO2 | 0 | 0.0044 | |
| H2 | 0 | 0.0044 |
| A. | 0~5min 时用H2O(g)表示的平均反应速率为1.2×10-3 mol/( L.min) | |
| B. | 5min~10min 改变的条件是再加入了0.1mol H2O(g) | |
| C. | 200℃时,若向容器中充入0.01mol CO(g)、0.01mol H2O(g)、0.01molCO2(g)、0.01molH2(g),达平衡时,CO(g)为1.2×10-3mol/L | |
| D. | 300℃时,若向容器中充入0.01mol CO(g)、0.01mol H2O(g)、0.02molCO2(g)、0.02molH2(g),则开始反应时ν(正)<ν(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| CO体积分数% 投料比 | 温度/℃ | ||||
| 200 | T2 | T3 | T4 | ||
| $\frac{n({H}_{2}0)}{n(C0)}$ | 1 | 1.70 | 2.73 | 6.00 | 7.85 |
| 3 | 0.21 | 0.30 | 0.84 | 1.52 | |
| 5 | 0.02 | 0.06 | 0.43 | 0.80 | |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酒精着火时应立即用水灭火 | |
| B. | 实验室制蒸馏水时应在蒸馏烧瓶中放入几粒碎瓷片 | |
| C. | 浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗 | |
| D. | 用试管加热碳酸氢钠固体时使试管口竖直向上 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com