
【题目】已知二氧化硅、二氧化硫和二氧化碳都是酸性氧化物,化学性质具有一定的相似性,镁和钠的化学性质也具有一定的相似性。

用如上图所示装置进行镁和二氧化硫的实验,其中A是制备二氧化硫的发生装置。
(1)选择制取二氧化硫的合适试剂________(填序号)。
①10%的硫酸溶液 ②80%硫酸溶液 ③亚硫酸钠固体 ④亚硫酸钙固体
(2)写出装置B中发生反应的化学方程式: ______________________。
(3)你认为该装置的不足之处是_______________________________(任写2条)。
【答案】 ②③ 3Mg+SO2![]() 2MgO+MgS或2Mg+SO2
2MgO+MgS或2Mg+SO2![]() 2MgO+S、Mg+S
2MgO+S、Mg+S![]() MgS 在A和B之间没有连接一干燥装置;C装置未与大气相通;在镁下方未垫一不锈钢片,镁与玻璃管反应;未设计一防倒吸装置(任写其中两条即可)
MgS 在A和B之间没有连接一干燥装置;C装置未与大气相通;在镁下方未垫一不锈钢片,镁与玻璃管反应;未设计一防倒吸装置(任写其中两条即可)
【解析】(1). 制取SO2应选用浓H2SO4和亚硫酸盐,但不可选用CaSO3,因为CaSO3与硫酸反应生成的CaSO4微溶于水,会附在固体表面,阻碍反应进行,所以选择的试剂为②③,故答案为:②③;
(2). Mg具有还原性,SO2具有氧化性,二者发生氧化还原反应,反应的方程式为3Mg+SO2![]() 2MgO+MgS或2Mg+SO2
2MgO+MgS或2Mg+SO2![]() 2MgO+S、Mg+S
2MgO+S、Mg+S![]() MgS,故答案为:3Mg+SO2
MgS,故答案为:3Mg+SO2![]() 2MgO+MgS或2Mg+SO2
2MgO+MgS或2Mg+SO2![]() 2MgO+S、Mg+S
2MgO+S、Mg+S![]() MgS;
MgS;
(3). 该装置存在的问题主要有: A中的水蒸气会进入B中与Mg反应,在A、B之间应连接一个干燥装置;Mg能与玻璃中的SiO2反应,在Mg下方应垫一不锈钢片,隔离Mg和玻璃管;尾气处理装置C的试管用胶塞封闭,且无防倒吸装置,故答案为:在A和B之间没有连接一干燥装置、C装置未与大气相通;在镁下方未垫一个不锈钢片、镁与玻璃管反应;未设计一防倒吸装置等。


科目:高中化学 来源: 题型:
【题目】我国已跨入“互联网+”时代,而“互联网+”的建设离不开无机非金属材料硅。下列物品中用到硅单质的是( )
A.计算机芯片B.陶瓷餐具C.石英钟表D.光导纤维
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某中学化学兴趣小组对乙醇的分子结构进行探究,其过程如下:
猜想一:乙醇的结构简式是CH3CH2OH
猜想二:乙醇的结构简式是CH3OCH3
制定方案并实施:按下图所示实验装置进行实验,

测定乙醇与钠反应(放热)生成氢气的体积,并据此计算乙醇分子中能与金属钠反应的氢原子的数目。
试回答下列问题:
(1)指出实验装置中的错误 。
(2)如果实验装置和操作正确,且结论符合猜想一,则参加反应的乙醇的物质的量与产生氢气的物质的量之比可能为 。
(3)如果实验装置和操作正确,且结论符合猜想二,则参加反应的乙醇的物质的量与产生氢气的物质的量之比可能为 。
(4)如果实验装置正确,实验结果为2.3 g乙醇与足量金属钠反应时产生了标准状况下的氢气约0.56 L,则乙醇的结构简式应为 ,理由是 。
(5)该实验获得成功的关键,除了需要纠正图中的装置错误以外,还需注意下列问题中的 (用序号填写)。
①装置的气密性良好;
②实验开始前准确测定乙醇的量;
③钠足量;
④广口瓶中水的体积大于560 mL;
⑤氢气的体积测算准确。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某气态烃在标准状况下密度为2.59 g·L-1。
(1)其相对分子质量等于________。
(2)该烃的含碳量为82.8%,则分子中碳、氢原子的个数比是________,分子式是________。
(3)可能的结构简式及名称是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去空气中的二氧化硫和氨氧化物气体对环境保护有重要意义。
(1)二氧化硫易溶于水,溶于水后所得溶液中H2SO3、HSO3-和SO32- 占三种粒子总数的比例随pH的变化如下图所示。由图可知H2SO3 的电离平衡常数Ka1=____________。

(2)利用尿素[CO(NH2)2]水解的溶液可以吸收含SO2 的空气。已知尿素水解放热,常温下水解反应较慢,水解的反应方程式如下:CO(NH2)2+H2O=H2NCOONH4(氨基甲酸铵)。
①氨基甲酸铵会与空气中的SO2 和O2 反应生成(NH4)2SO4,该反应的化学方程式为__________。
②一定条件下,用尿素溶液吸收含SO2 的空气,测得SO2 的吸收率随溶液的温度变化如图甲所示。温度高于60 ℃时,SO2 的吸收率逐渐升高的原因是_____________。
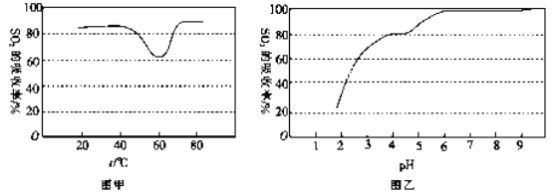
③尿素溶液吸收SO2 的吸收率随溶液的pH变化如图乙所示。尿素溶液吸收含SO2的空气后溶液的pH会降低,为提高SO2 的吸收率和充分回收产物,最好向溶液中加入_____(填溶液的名称)并控制pH 为_______。
(3)一种电化学脱硝法的原理如图所示。
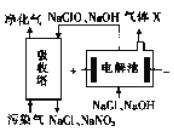
①电解池阴极所发生的电极反应为_____________。
②相同条件下通入的污染气和生成的X 的体积比为40 :3,污染气中NO 和NO2 占总体积的10%,若NaClO完全反应,污染气中NO和NO2 被完全吸收且其余气体不参与反应,则NO和NO2 的体积比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X,Y均得1个电子达到8e﹣的稳定结构,且X得电子放出的能量大于Y得电子放出的能量,则下列说法不正确的是( )
A.X,Y同主族
B.X原子的半径大于Y原子的半径
C.X的非金属性强于Y的非金属性
D.X﹣的还原性弱于Y﹣的还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某液态烃的球棍模型为: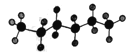 ,有机物R与该烃分子式相同,且结构中有四个甲基。下列有关R的说法中正确的是
,有机物R与该烃分子式相同,且结构中有四个甲基。下列有关R的说法中正确的是
A. R能使溴的四氯化碳溶液褪色 B. R一定是2,2-二甲基丁烷
C. R不溶于水且密度比水大 D. R的一氯代物可能有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化合物的化学式为(NH4)2Fe(SO4)2 ,它在水溶液里电离时生成两种阳离子和一种酸根离子
(1)写出硫离子的结构示意图________________;
(2)若向该化合物的水溶液中通入氯气,一种离子很容易被氧化,该离子将变成______;(用离子符号表示)
(3)若向该化合物的水溶液中加入过量一种碱溶液,只能发生一个离子反应,则该反应的离子方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个固定体积的密闭容器中,加入2mol A和1mol B发生反应:2A(g)+B(g)![]() 3C(g)+D(g),达到平衡时,C的浓度为W mol/L,若维持容器体积和温度不变,按下列四种方法改变起始物质,达到平衡后,C的浓度仍为W mol/L的是
3C(g)+D(g),达到平衡时,C的浓度为W mol/L,若维持容器体积和温度不变,按下列四种方法改变起始物质,达到平衡后,C的浓度仍为W mol/L的是
A. 4molA+2molB B. 2molA+1molB+3molC+1molD
C. 3molC+1molD+1molB D. 3molC+1molD
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com