
【题目】目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究.已知在不同温度下的化学反应平衡常数(K1、K2、K3)如表所示:
目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究.已知在不同温度下的化学反应平衡常数(K1、K2、K3)如表所示:
化学反应 | 焓变 | 平衡常数 | 温度/℃ | ||
500 | 700 | 800 | |||
①2H2(g)+CO(g)CH3OH(g) | △H1 | K1 | 2.5 | 0.34 | 0.15 |
②CO2(g)+H2(g)CO(g)+H2O(g) | △H2 | K2 | 1.0 | 1.70 | 2.52 |
③CO2(g)+3H2(g)CH3OH(g)+H2O(g) | △H3 | K3 | |||
请回答下列问题:
(1)反应②是(填“吸热”或“放热”)反应.
(2)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=(用K1、K2表示),
△H3═(用△H1、△H2表示);根据反应③判断△S0(填“>”、“=”或“<”),在(填“较高”或“较低”)温度下有利于该反应自发进行.
(3)要使反应③在一定条件下建立的平衡正向移动,可采取的措施有(填写字母序号).
A.缩小反应容器的容积
B.扩大反应容器的容积
C.升高温度
D.降低温度
E.使用合适的催化剂
F.从平衡体系中及时分离出CH3OH
(4)500°C时,测得反应③在某时刻,CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度分别为0.1molL﹣1、0.3molL﹣1、0.3molL﹣1、0.15molL﹣1 , 则此时v正v逆(填“>”、“=”或“<”).
(5)根据表格测得焓变,下列能量关系图合理的是 . 
(6)某兴趣小组研究反应②的逆反应速率在下列不同条件下随时间的变化曲线,开始时升温,t1时平衡,t2时降压,t3时增加CO浓度,t4时又达到平衡.请画出t2至t4的曲线. 
【答案】
(1)吸热
(2)K1×K2;△H1+△H2;<;较低
(3)ADF
(4)<
(5)AD
(6)解: 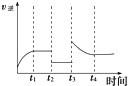
【解析】解:(1)反应②平衡常数随温度升高增大,说明升高温度平衡正向进行,正反应是吸热反应,
所以答案是:吸热;(2)反应①+②可得反应③,则平衡常数K3=K1×K2 , 反应③是气体体积减小的反应△S<0,反应③3H2(g)+CO2(g)═CH3OH(g)+H2O(g)是气体体积减小的反应△S<0,分析反应特征可知平衡常数K3=K1×K2 , 计算不同温度下反应③的平衡常数,500°C时,K3=K1×K2=2.5×1.0=2.5,800°C时,K3=K1×K2=2.52×0.15=0.375,结合温度变化分析,随温度升高,平衡常数减小,平衡逆向进行,所以判断反应是放热反应,焓变△H<0,所以反应在低温下能自发进行,依据反应①+②得到反应③,所以平衡常数K3=K1×K2;所以△H3═△H1+△H2;
所以答案是:K1×K2;△H3═△H1+△H2;<;较低;(3)A.缩小反应容器的容积,缩小反应容器的容积,压强增大,平衡向正向移动,故正确;
B.扩大反应容器的容积,扩大反应容器的容积,压强减小,平衡逆向移动,故错误;
C.由于K3=K1×K2 , 由表中数据可知,升高温度平衡常数减小,平衡逆向移动,故错误;
D.由于K3=K1×K2 , 由表中数据可知,降低温度平衡常数增大,平衡正向移动,故正确;
E.使用合适的催化剂,可以加快反应速率,但不影响平衡移动,故错误;
F.从平衡体系中及时分离出CH3OH,生成物浓度减小,平衡正向移动,故正确,
故选:ADF;(4)500℃时K3=K1×K2=2.5,浓度商Qc= ![]() =16>K=2.5,反应向逆反应进行,故v(正)<v(逆),
=16>K=2.5,反应向逆反应进行,故v(正)<v(逆),
所以答案是:<;(5)A、反应②已经平衡常数随温度变化分析为吸热反应,反应物能量低于生成物,图象符合,故A正确;
B、催化剂改变反应速率不改变化学平衡,平衡状态不变,图象不符合,故B错误;
C、①2H2(g)+CO(g)CH3OH(g),依据数据分析,平衡常数随温度 升高减小,说明正反应为放热反应,反应物能量高于生成物,图象不符合,故C错误;
D、反应③3H2(g)+CO2(g)═CH3OH(g)+H2O(g)是放热盐,反应物能量高于生成物,图象符合,故D正确;
所以答案是:AD;(6)反应②CO2(g)+H2(g)CO(g)+H2O(g)是气体体积不变的吸热反应,反应的逆反应速率在下列不同条件随时间的变化曲线,开始时升温,逆反应速率增大,t1时平衡,t2时降压,逆反应速率减小,平衡不变,t3时增加CO浓度,此时刻逆反应速率增大,随反应进行减小,大平衡状态大于t2﹣t3平衡状态的逆反应速率,t4时又达到平衡,依据反应速率影响分析绘制出去下变化;画出t2至t4的曲线为如图所示 ;
;
所以答案是:  .
.
【考点精析】通过灵活运用化学平衡状态本质及特征,掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效)即可以解答此题.


 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:
【题目】下列“试剂”和“试管中的物质”不能完成“实验目的”的是( )
实验目的 | 试剂 | 试管中的物质 | |
A | 羟基对苯环的活性有影响 | 饱和溴水 | ①苯②苯酚溶液 |
B | 甲基对苯环的活性有影响 | 酸性KMnO4溶液 | ①苯②甲苯 |
C | 苯分子中没有碳碳双键 | Br2的CCl2溶液 | ①苯②乙烯 |
D | 碳酸的酸性比苯酚强 | 石蕊溶液 | ①苯酚溶液②碳酸溶液 |

A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中所涉及的A、B、C、D、E、F和G等都是中学化学教材中常见物质。其中B、E为金属单质,D为气体。反应① ②是置换反应,反应① ② ③均在高温下进行。A为常温下最常见的液体,C有磁性,E、F既能溶于NaOH又能溶于HCl。
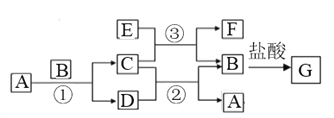
(1)C的化学式_____________, E与足量盐酸反应的离子方程式_________________;
(2)反应③ 化学方程式_______________________;E加入过量的NaOH溶液对应离子反应方程式_______________________;
(3)G溶液中加入酸性的H2O2溶液后变黄色,对应离子反应方程式_________________;
(4)F与氢氧化钠反应的化学方程式为_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是 ( )
A.工业制取硫酸过程中生成的SO2可循环利用
B.钢铁因含杂质而容易生锈,所以合金一定不耐腐蚀
C.沙子、石英、水晶、硅藻土都是天然存在的二氧化硅
D.在医疗上硫酸亚铁可用作生产防治缺铁性贫血的药剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于ⅣA族元素,下列叙述中不正确的是( )
A. SiO2和CO2中Si和O,C和O之间都是共价键
B. C、Si、Ge的最外层电子数都是4,次外层电子数都是8
C. CO2和SiO2都是酸性氧化物,在一定条件下都能和氧化钙反应
D. 该族元素的主要化合价是+4和+2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科学实验小组将6mol A和 8mol B 充入2L的密闭容器中,某温度下,发生的反应为A(g)+3B(g)C(g)+D(g)△H=﹣49.0 kJmol﹣1 . 测得B的物质的量随时间变化的关系如图所示(实线). 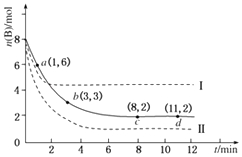
(1)下列时间段A的平均反应速率最大的是(填选项字母,下同),最小的是 .
A.0~1min B.1~3min C.3~8min D.8~11min
(2)b点的正反应速率(填“大于”“等于”或“小于”)逆反应速率.
(3)平衡时B的转化率为 , 该温度下的化学平衡常数K= .
(4)仅改变某一实验条件再进行两次实验,测得B的物质的量随时间变化如图中虚线所示.则曲线Ⅰ改变的条件是 , 曲线Ⅱ改变的条件是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中能表示将Ba(OH)2溶液逐滴加入到硫酸铝溶液中,产生沉淀的质量(W)与加入Ba(OH)2溶液的体积(V)关系的是( )
A.
B.
C.
D.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com