
常温下,向l00 mL 0.01 mol/LHA溶液中逐滴加入0.02 mol/LMOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计)。下列说法中,正确的是
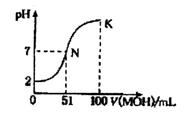
A.HA为一元强酸,MOH为一元强碱
B.K点所示溶液中c(A-)>c(M+)
C.N点水的电离程度小于K点水的电离程度
D.K点对应的溶液的pH=10,则有c(MOH)+c(OH-)-c(H+)=0.005mol/L
【答案】D
【解析】
试题分析:A、根据图象可知,加入氢氧化钠溶液前,0.01mol•L-1HA溶液的pH=2,说明HA在溶液中完全电离,则HA是强酸。当加入51ml0.02mol/LMOH溶液时,MOH过量,但溶液显中性,这说明MOH应该是弱碱,故A错误;B、K点溶液是MOH与MA的混合液,且二者的浓度相等,但溶液呈碱性,MOH的电离程度大于M+的水解程度,则c(M+)>c(A-),B错误;C、由图象可知,N点溶液呈中性,水电离的氢离子为10-7mol/l, MOH电离的氢氧根离子抑制了水电离,水电离的氢离子小于10-7mol/l,所以N点水的电离程度大于K点水的电离程度,故C错误;D、在K点时混合溶液体积是碱溶液的2倍,根据物料守恒结合溶液体积变化知,c(MOH)+c(M+)=0.01mol•L-1,根据电荷守恒得c(M+)+c(H+)=c(OH-)+c(A-),c(MOH)+c(OH-)-c(H+)=c(M+)-c(A-)+c(MOH)=0.01mol•L-1-0.005mol•L-1=0.005mol•L-1,故D正确;故选D。
考点:考查酸碱混合时的定性判断、弱电解质电离及其影响因素


 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
一定条件下,在容积为10L的密闭容器中,将l mol X和1 mol Y进行如下反应:2X(g)+Y(g) Z(g),经60 s达到平衡生成0.3 mol的Z,下列说法正确的是
Z(g),经60 s达到平衡生成0.3 mol的Z,下列说法正确的是
A.60 s内X的平均反应速率为0.01 mol·L-1·s-1
B.升高温度,若X的体积分数减小,则正反应的△H<0
C.将容器的容积变为20 L,达平衡后Z的浓度为0.015 mol·L-1
D.保持温度和体积不变,若再充入1 mol X,Y的转化率将增大
查看答案和解析>>
科目:高中化学 来源: 题型:
对于4℃时100mL水中溶解了22.4 L HCl气体(标准状况下测得)后形成的溶液,下列说法中正确的是
A.该溶液物质的量浓度为10moL/L
B.所得的溶液的体积为22.5L
C.根据题干数据,该溶液物质的量浓度无法求得
D.该溶液中溶质的质量分数因溶液的密度未知而无法求得
查看答案和解析>>
科目:高中化学 来源: 题型:
银质器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故。根据电化学原理可进行如下处理:在铝质容器中加入食盐溶液,再将变黑的银器漫入该溶液中,一段时间后发现黑色会褪去。下列说法正确的是
A.处理过程中银器一直保持恒重
B.银器为正极,Ag2S被还原生成单质银
C.该过程中总反应为2Al+3Ag2S=6Ag+A12S3
D.黑色褪去的原因是黑色Ag2S转化为白色AgC1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作与预期实验目的或所得实验结论一致的是
| 选项 | 实验操作 | 实验目的或结论 |
| A | 向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌一段时间后过滤 | 除去MgCl2溶液中少量FeCl3 |
| B | 向某溶液中加入BaCl2溶液生成白色沉淀,继续加稀硝酸沉淀不消失 | 证明溶液中含有SO42- |
| C | 向某溶液中加入稀盐酸,放出无色无味气体,将气体通入澄清石灰水 ,石灰水变浑浊 | 证明该溶液中存在CO32- |
| D | 向0.1mol•L-1FeSO4溶液中滴加少量酸性KMnO4溶液,KMnO4溶液褪色 | 说明Fe2+具有氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是某化学兴趣小组设计的利用电子垃圾(含70%Cu、25%Al、4%Fe及少量Au、Pt)制备硫酸铜和硫酸铝晶体的路线:
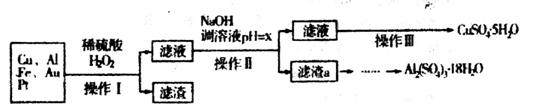
已知下列信息:Cu可与稀硫酸和H2O2的混合液反应生成硫酸铜;铁、铝、铜等离子以氢氧化物形式沉淀时溶液的pH如下表:
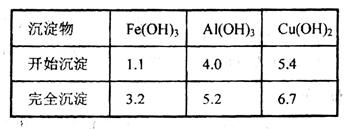
请回答下列问题:
(1)写出Cu与稀硫酸和H2O2的混合液反应的化学方程式______________。
(2)在操作II中,x的取值范围是___________________。
(3)在操作III中,蒸发浓缩需要的玻璃仪器有______________________________________。
(4)由滤渣a制取Al2(SO4)3•18H2O,探究小组设计了三种方案:
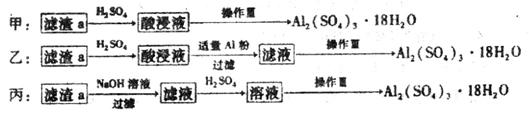
综合考虑上述三种方案,最具可行性的是___________(填序号)。
(5)为测定CuSO4•5H2O晶体的纯度,进行下列实验:取a g 试样配成100mL溶液,每次取20.00mL,消除干扰离子后,用b mol/LEDTA(Na2H2Y)标准溶液滴定其中的Cu2+(离子方程式为Cu2++H2Y2-=CuY2-+2H+),滴定至终点,平均消耗EDTA溶液12.00mL,CuSO4•5H2O晶体的纯度是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
利用一种新型陶瓷(能传递H+),实现了氨的电化学合成。该过程N2和H2的转化率远高于现在工业上使用的氨合成法。对于电化学合成氨的有关叙述正确的是( )
A.N2在阴极上被氧化 B.可选用铁作为阳极材料
C.阳极的电极反应式是N2+6H++6e-===2NH3
D.该过程的总反应式是N2+3H2  2NH3
2NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验事故处理的方法中,正确的是( )
A.不慎把较多浓硫酸沾在手上,立即用大量水冲洗后再涂抹NaHCO3溶液
B.不慎将浓碱液沾到皮肤上,应立即用大量水冲洗,然后涂抹盐酸溶液
C.如果汽油、煤油等可燃物着火,应立即用水扑灭
D.酒精灯不慎碰翻着火,应立即用湿布盖灭
查看答案和解析>>
科目:高中化学 来源: 题型:
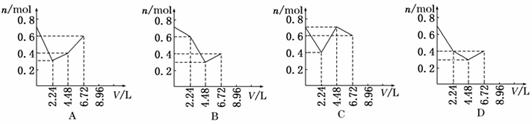
往含0.2 mol KOH和0.1 mol Ca(OH)2的溶液中持续地通入CO2气体,当通入气体的体积为6.72 L(标准状况)时立即停止,则在这一过程中,溶液中离子的物质的量n和通入CO2的体积V的关系示意图正确的是(气体的溶解忽略不计) ( )
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com