
【题目】在2L密闭容器内,800℃时反应:2NO(g)+O2(g) ![]() 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)NO的平衡浓度c(NO)= .
(2)用O2表示从0﹣2s内该反应的平均反应速率v= .
(3)如图中表示NO2变化的曲线是 . 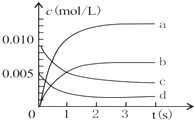
(4)能说明该反应已达到平衡状态的是 . a.v(NO2)=2v(O2)
b.容器内气体总物质的量保持不变
c.V逆(NO)=2v正(O2)
d.容器内气体的密度保持不变.
【答案】
(1)3.5×10﹣3mol?L﹣1
(2)1.5×10﹣3mol?L﹣1?s﹣1
(3)b
(4)bc
【解析】解:(1)由表中数据可知从3s开始,NO的物质的量为0.007mol,不再变化,3s时反应达平衡,所以平衡时NO的浓度为 ![]() =3.5×10﹣3molL﹣1 , 所以答案是:3.5×10﹣3molL﹣1;(2)2s内用NO表示的平均反应速率v(NO)=
=3.5×10﹣3molL﹣1 , 所以答案是:3.5×10﹣3molL﹣1;(2)2s内用NO表示的平均反应速率v(NO)= ![]() =
= ![]() =3.0×10﹣3molL﹣1s﹣1 , 速率之比等于化学计量数之比,所以v(O2)=
=3.0×10﹣3molL﹣1s﹣1 , 速率之比等于化学计量数之比,所以v(O2)= ![]() v(NO)=
v(NO)= ![]() ×3.0×10﹣3molL﹣1s﹣1=1.5×10﹣3molL﹣1s﹣1 , 所以答案是:1.5×10﹣3molL﹣1s﹣1;(3)NO2是产物,随反应进行浓度增大,平衡时浓度为NO浓度的变化量△c(NO)=
×3.0×10﹣3molL﹣1s﹣1=1.5×10﹣3molL﹣1s﹣1 , 所以答案是:1.5×10﹣3molL﹣1s﹣1;(3)NO2是产物,随反应进行浓度增大,平衡时浓度为NO浓度的变化量△c(NO)= ![]() =0.0065mol/L,所以图中表示NO2变化的曲线是b,所以答案是:b;(4)a、表示同一方向反应速率,v(NO2)自始至终为v(O2)的2倍,不能说明达到平衡,故a错误;b、随反应进行,反应混合气体总的物质的量在减小,气体总物质的量保持不变,说明反应到达平衡,故b正确;c、不同物质表示速率,到达平衡时,正逆速率之比等于化学计量数之比,V逆 (NO):正(O2)=2:1,即V逆 (NO)=2v正(O2),故c正确;d、混合气体的总质量不变,容器容积为定值,所以密度自始至终不变,不能说明达到平衡,故d错误.所以答案是:bc.
=0.0065mol/L,所以图中表示NO2变化的曲线是b,所以答案是:b;(4)a、表示同一方向反应速率,v(NO2)自始至终为v(O2)的2倍,不能说明达到平衡,故a错误;b、随反应进行,反应混合气体总的物质的量在减小,气体总物质的量保持不变,说明反应到达平衡,故b正确;c、不同物质表示速率,到达平衡时,正逆速率之比等于化学计量数之比,V逆 (NO):正(O2)=2:1,即V逆 (NO)=2v正(O2),故c正确;d、混合气体的总质量不变,容器容积为定值,所以密度自始至终不变,不能说明达到平衡,故d错误.所以答案是:bc.
【考点精析】掌握化学平衡状态的判断和化学平衡的计算是解答本题的根本,需要知道状态判断:①v(B耗)=v(B生)②v(C耗):v(D生)=x : y③c(C)、C%、n(C)%等不变④若A、B、C、D为气体,且m+n≠x+y,压强恒定⑤体系颜色不变⑥单位时间内某物质内化学键的断裂量等于形成量⑦体系平均式量恒定(m+n ≠ x+y)等;反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案科目:高中化学 来源: 题型:
【题目】聚戊二酸丙二醇酯(PPG)是一种可降解的聚酯类高分子材料,在材枓的生物相容性方面有很好的应用前景。 PPG的一种合成路线如下:
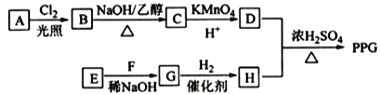
已知:①烃A的相对分子质量为70,核磁共振氢谱显示只有一种化学环境的氢;
②化合物B为单氯代烃:化合物C的分子式为C5H8;
③E、F为相对分子质量差14的同系物,F是福尔马林的溶质;
④![]()
回答下列问题:
(1)A的结构简式为____________。
(2)由B生成C的化学方程式为___________________________。
(3)由E和F生成G的反应类型为_____________。
(4)由D和H生成PPG的化学方程式为_________________________。
(5)D的同分异构体中能同时满足下列条件的共有______种(不含立体异构):
①能与饱和NaHCO3溶液反应产生气体
②既能发生银镜反应,又能发生皂化反应
其中核磁共振氢谱显示为3组峰,且峰面积比为6:1:1的是________(写结构简式)
(6)D的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同,该仪器是___________(填标号)。
a. 质谱仪 b.红外光谱仪 c.元素分析仪 d.核磁共振仪
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属的说法中,不正确的是( )
A. 青铜、不锈钢都是合金 B. 铜在空气中会生成铜诱
C. 多数合金的熔点高于组成它的成分金属的熔点 D. 铝是活泼金属,但在空气中耐腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A.钠和冷水反应:Na+2H2O═Na++2OH﹣+H2↑
B.金属铝溶于氢氧化钠溶液中:Al+2OH﹣═Al ![]() +H2↑
+H2↑
C.金属铝溶于盐酸中:2Al+6H+═2Al3++3H2↑
D.Fe(OH)3跟盐酸反应:OH﹣+H+═H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下在固定容积的容器中进行的可逆反应:2M(g)+N(g)![]() Q(g) △H>0,达到平衡状态,若升高温度,则对于该混合气体下列说法正确的是( )
Q(g) △H>0,达到平衡状态,若升高温度,则对于该混合气体下列说法正确的是( )
A. 密度增大 B. 平均相对分子质量增大
C. 总分子数增大 D. 平衡逆向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的是( ) 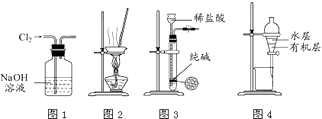
A.用图1所示装置除去Cl2中含有的少量HCl
B.用图2所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
C.用图3所示装置制取少量纯净的CO2气体
D.用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对Zn+2MnO2+2H2O=2MnO(OH)+Zn(OH)2,下列说法错误的是
A.氧化产物和还原产物的物质的量之比为2:1
B.MnO(OH)中Mn的化合价为+3价
C.MnO2在反应中被还原
D.Zn是此反应中还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示从废旧普通锌锰电池内容物中回收制备KMnO4等物质的一种工艺(不考虑废旧电池中实际存在的少量其他金属)。
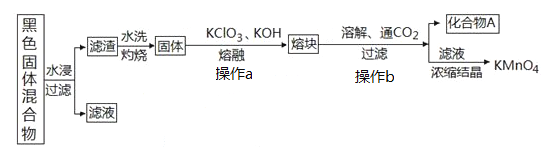
(1)KMnO4稀溶液是一种常用消毒剂,其消毒机理与下列物质相似的是______________(填序号)
A.双氧水 B.75%酒精 C.苯酚 D.84消毒液(NaClO溶液)
(2)①黑色固体混合物水浸时为提高浸出速率,常采用的措施为_________________(答出两条即可)。
②滤渣水洗灼烧后固体是一种黑色的化合物,操作a中得到熔块的主要成分是K2MnO4和KCl,该过程中发生反应的化学方程式为:_____________________________。
③图中产物A是一种难溶于水的黑色固体,其化学式为:_________________。
(3)测定KMnO4产品的纯度可用标准Na2S2O3溶液进行滴定。
①配制250mL0.1000mol·L-1标准Na2S2O3溶液,需要使用的玻璃仪器有烧杯、胶头滴管、量筒和______、_______;
②取上述制得的KMnO4产品0.7000g,酸化后用0.1000mol·L-1标准Na2S2O3溶液进行滴定,滴定至终点记录实验消耗Na2S2O3溶液的体积,重复步骤②,三次平行实验数据如下表。
实验次数 | 1 | 2 | 3 |
消耗Na2S2O3溶液体积/mL | 19.30 | 20.98 | 21.02 |
(有关离子方程式为:MnO4-+S2O32-+H+—SO42-+Mn2++H2O,未配平)
将0.1000mol·L-1标准Na2S2O3溶液盛装在________(填“酸式”或“碱式”)滴定管中进行滴定。计算该KMnO4产品的纯度_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com