
【题目】Ⅰ已知34Se的原子结构示意图如图所示,回答下列问题:

(1)Se在元素周期表中的位置是__________。
(2)由Se在周期表中的位置分析判断下列说法正确的是__________。
A.热稳定性:PH3>H2S>H2Se B.还原性:H2Se>HBr>HCl
C.离子半径:Se2->Cl->K+ D.酸性:HClO3>HBrO3>H2SeO3
Ⅱ在温度t1和t2下,X2(g)和H2反应生成HX的平衡常数如下表:
化学方程式 | K(t1) | K(t2) |
F2+H2===2HF | 1.8×1036 | 1.9×1032 |
Cl2+H2===2HCl | 9.7×1012 | 4.2×1011 |
Br2+H2===2HBr | 5.6×107 | 9.3×106 |
I2+H2===2HI | 43 | 34 |
(1)已知,HX的生成反应是放热反应,则温度t2__________t1(填“<”或“>”)。
(2)用电子式表示HX的形成过程__________。
(3)共价键的极性随共用电子对偏移程度的增大而增强,HX共价键的极性由强到弱的顺序是__________。
(4)X2都能与H2反应生成HX,用原子结构解释原因:__________。
(5)K的变化体现出X2化学性质的递变性,用原子结构解释原因:__________,原子半径逐渐增大,得电子能力逐渐减弱。
(6)仅依据K的变化,可以推断出:随着卤素原子核电荷数的增加,__________(选填字母)。
a.在相同条件下,平衡时X2的转化率逐渐降低 b.HX的稳定性逐渐减弱
c.X2与H2反应的剧烈程度逐渐减弱 d.HX的还原性逐渐减弱
(7)不同卤素原子之间可形成卤素互化物,其性质与卤素单质相近。写出BrCl和SO2在水溶液中发生反应的化学方程式__________.
【答案】 第4周期第ⅥA族 BC > ![]() HF、HCl、HBr、HI 卤素原子的最外层电子数都是7 同一主族元素从上至下原子核外电子层数依次增多 ab BrCl+SO2+2H2O=H2SO4+HCl+HBr
HF、HCl、HBr、HI 卤素原子的最外层电子数都是7 同一主族元素从上至下原子核外电子层数依次增多 ab BrCl+SO2+2H2O=H2SO4+HCl+HBr
【解析】I.(1). 根据Se的原子结构示意图可知,Se有四个电子层,最外层有6个电子,因电子层数等于周期数、最外层电子数等于主族序数,所以Se元素位于元素周期表的第4周期第VIA族,故答案为:第4周期第VIA族;
(2) A. 同一周期从左到右元素的非金属性逐渐增强,同一主族从上到下元素的非金属性逐渐减弱,则非金属性S>P、S>Se,又因元素的非金属性越强,其气态氢化物热稳定性越强,所以热稳定性H2S>PH3、H2S>H2Se,故A错误;B. 非金属性Cl>Br>Se,因非金属性越强,其对应阴离子的还原性越弱,则还原性:H2Se>HBr>HCl,故B正确;C. 电子层数越多,离子半径越大,则离子半径Se2->Cl-,具有相同核外电子排布的离子,原子序数越大,离子半径越小,则离子半径Cl->K+,所以离子半径:Se2->Cl->K+,故C正确;D. 最高价氧化物对应的水化物酸性越强,元素的非金属性越强,但HClO3、HBrO3、H2SeO3均不是该元素的最高价氧化物对应的水化物,所以无法比较酸性强弱,故D错误;答案选BC;
II. (1). 因HX的生成反应是放热反应,则升高温度,平衡逆向移动,平衡常数减小,由表中数据可知,K(t1)>K(t2),说明t2>t1,故答案为:>;
(2). 因HX都是共价化合物,氢原子最外层电子与X原子最外层电子形成一对共用电子对,其形成过程可表示为:![]() ,故答案为:
,故答案为:![]() ;
;
(3). F、Cl、Br、I属于ⅦA族元素,同主族元素自上而下随着核电荷数的增大,原子核外电子层数逐渐增多,导致原子半径逐渐增大,因此原子核对最外层电子的吸引力逐渐减弱,从而导致非金属性逐渐减弱,即这四种元素得到电子的能力逐渐减弱,所以HF键的极性最强,HI的极性最弱,因此HX共价键的极性由强到弱的顺序是HF、HCl、HBr、HI,故答案为:HF、HCl、HBr、HI;
(4). 卤素原子的最外层电子数均为7个,在反应中均易得到1个电子而达到8电子的稳定结构,而H原子最外层有一个电子,在反应中也能得到1个电子而达到2电子的稳定结构,因此卤素单质与氢气化合时易通过一对共用电子对形成化合物HX,故答案为:卤素原子的最外层电子数都是7;
(5). 平衡常数越大,说明反应越易进行,F. Cl、Br、I的得电子能力依次减小的主要原因是:同一主族元素从上至下原子核外电子层数依次增多,原子半径逐渐增大,得电子能力逐渐减弱造成的,故答案为:同一主族元素从上至下原子核外电子层数依次增多;
(6). a. K值越大,说明反应的正向程度越大,即转化率越高,故a正确;b. 反应的正向程度越小,说明生成物越不稳定,故b正确;而选项c、d都与K的大小无直接关系,故c、d错误;答案选ab;
(7). 不同卤素原子之间可形成卤素互化物,其性质与卤素单质相近,根据氯气与二氧化硫反应生成HCl和硫酸的原理可以推断BrCl和SO2在水溶液中发生反应的化学方程式为:BrCl+SO2+2H2O=H2SO4+HCl+HBr,故答案为:BrCl+SO2+2H2O=H2SO4+HCl+HBr。
【题型】综合题
【结束】
16
【题目】CH4超干重整CO2技术可得到富含CO的气体,用于生产多种化工产品。该技术中的化学反应为:CH4(g)+3CO2(g) ![]() 2H2O(g)+4CO(g) ΔH=+330kJ/mol
2H2O(g)+4CO(g) ΔH=+330kJ/mol
(1)下图表示初始投料比n(CH4):n(CO2)为1:3或1:4,CH4的转化率在不同温度(T1、T2)下与压强的关系。[注:投料比用a1、a2表示]
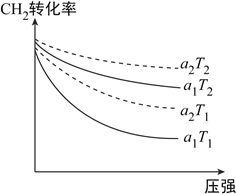
①a2=__________。
②判断T1的T2的大小关系,并说明理由:__________。
(2)CH4超干重整CO2的催化转化原理示意图如下:

①过程Ⅰ,生成1mol H2时吸收123.5kJ热量,其热化学方程式是__________。
②过程Ⅱ,实现了含氢物种与含碳物种的分离。生成H2O(g)的化学方程式是__________。
③假设过程Ⅰ和过程Ⅱ中的各步均转化完全,下列说法正确的是__________。(填序号)
a.过程Ⅰ和过程Ⅱ中发生了氧化还原反应
b.过程Ⅱ中使用的催化剂为Fe3O4和CaCO3
c.若过程Ⅰ投料![]() ,可导致过程Ⅱ中催化剂失效
,可导致过程Ⅱ中催化剂失效
【答案】 1:4 T2>T1 正反应为吸热反应,温度升高时甲烷的转化率增大 CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=+247kJ/mol 4H2+Fe3O4![]() 3Fe+4H2O ac
3Fe+4H2O ac
【解析】(1). ①.在相同条件下,投料比越小,甲烷的转化率越大,据图可知,a2>a1,故a2表示的是1:4时甲烷的转化率,故答案为:1:4;
②. 因CH4(g)+3CO2(g)![]() 2H2O(g)+4CO(g)的正反应为吸热反应,温度升高时,平衡正向移动,甲烷的转化率增大,则T2>T1,故答案为:T2>T1,正反应为吸热反应,温度升高时甲烷的转化率增大;
2H2O(g)+4CO(g)的正反应为吸热反应,温度升高时,平衡正向移动,甲烷的转化率增大,则T2>T1,故答案为:T2>T1,正反应为吸热反应,温度升高时甲烷的转化率增大;
(2). ①.在过程I中,生成1mol H2时吸收123.5kJ热量,据图可知,其热化学方程式为:CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=+247kJ/mol,故答案为:CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=+247kJ/mol;
②. 由过程II的转化关系来看,混合气体中的H2将Fe3O4还原为Fe,反应方程式为:4H2+Fe3O4 ![]() 3Fe+4H2O,故答案为:4H2+Fe3O4
3Fe+4H2O,故答案为:4H2+Fe3O4 ![]() 3Fe+4H2O;
3Fe+4H2O;
③. a. 两个过程都有元素化合价的改变,都发生了氧化还原反应,故a正确;b. 过程II中Fe3O4最终被还原为Fe,Fe3O4不是催化剂,故b错误;c. 若初始投料比![]() 时,二者恰好按照题给方程式反应,无CO2生成,导致CaCO3无法参加反应,使催化剂中毒失效,故c正确;答案选ac。
时,二者恰好按照题给方程式反应,无CO2生成,导致CaCO3无法参加反应,使催化剂中毒失效,故c正确;答案选ac。


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】Fe和Fe2O3的混合物15g,加入150mL稀硫酸中,标准状况下放出H21.68L,同时固体全部溶解.向溶液中滴加硫氰化钾溶液后,未见颜色变化.若向溶液中加入3molL﹣1 NaOH溶液200mL,恰好使铁元素全部沉淀.则该稀硫酸的物质的量浓度为( )
A.2.25molL﹣1
B.2molL﹣1
C.0.6molL﹣1
D.0.3molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应中,是氧化还原反应的是( )
A. 2NaOH+H2SO4===Na2SO4+2H2O
B. FeO+H2SO4===FeSO4+H2O
C. BaCl2+H2SO4===BaSO4↓+2HCl
D. H2+CuO===Cu+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)![]() Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断正确的是
A. 增加c(CO),平衡向正向移动,反应的平衡常数增大
B. 第一阶段,在30℃和50℃两者之间选择反应温度,选50℃
C. 第二阶段,Ni(CO)4分解率较低
D. 该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非金属单质A经如图所示的过程转化为含氧酸D,已知D为强酸,请回答下列问题。
![]()
![]()
![]()
![]()
![]()
![]()
![]()
(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体:
①D的化学式是________;
②在工业生产中,B气体的大量排放被雨水吸收后形成了________而污染了环境。
(2)若A在常温下为气体,C是红棕色的气体:
①A、C的化学式分别是:A________;C________。
②D的浓溶液在常温下可与铜反应并生成C气体,请写出该反应的化学方程式_______________________________________________。该反应________(填“属于”或“不属于”)氧化还原反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为不同化学元素组成的化合物示意图,下列说法正确的是( )

A. 若图中①为某种化合物的基本单位,则①最可能是核苷酸
B. 若②广泛分布在动物细胞内,则其一定是糖原
C. 若③为生物大分子,则其彻底水解产物最多为4种
D. 若④为重要储能物质,则动物和植物细胞都含有这种物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工、农业废水以及生活污水中浓度较高的![]() 会造成氮污染。工业上处理水体中
会造成氮污染。工业上处理水体中![]() 的一种方法是零价铁化学还原法。某化学小组用废铁屑和硝酸盐溶液模拟此过程,实验如下。
的一种方法是零价铁化学还原法。某化学小组用废铁屑和硝酸盐溶液模拟此过程,实验如下。
(1)先用稀硫酸洗去废铁屑表面的铁锈,然后用蒸馏水将铁屑洗净。
①除锈反应的离子反程式是__________。
②判断铁屑洗净的方法是__________。
(2)将KNO3溶液的pH调至2.5。从氧化还原的角度分析调低溶液pH的原因是__________。
(3)将上述处理过的足量铁屑投入(2)的溶液中。如图表示该反应过程中,体系内相关离子浓度、pH随时间变化的关系。请根据图中信息回答:
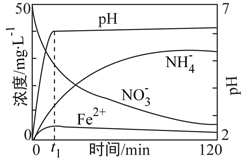
①t1时刻前该反应的离子方程式是__________。
②t2时刻后,该反应仍在进行,溶液中![]() 的浓度在增大,Fe2+的浓度却没有增大,可能的原因是__________。
的浓度在增大,Fe2+的浓度却没有增大,可能的原因是__________。
(4)铁屑与KNO3溶液反应过程中向溶液中加入炭粉,可以增大该反应的速率,提高![]() 的去除效果,其原因是__________。
的去除效果,其原因是__________。
【答案】 Fe2O3+6H+=2Fe3++3H2O 测最后一次洗涤液的pH,若为7,则说明铁屑已洗净(或取少量最后一次洗涤液加入BaCl2溶液,若无明显现象,则说明铁屑已洗净) ![]() 在酸性条件下的氧化性强,易被铁屑还原 4Fe+
在酸性条件下的氧化性强,易被铁屑还原 4Fe+![]() +10H+=4Fe2++
+10H+=4Fe2++![]() +3H2O 生成的Fe2+水解 炭粉和铁构成了无数微小的原电池加快反应速率
+3H2O 生成的Fe2+水解 炭粉和铁构成了无数微小的原电池加快反应速率
【解析】(1). ①. 铁锈的主要成分是Fe2O3,与稀硫酸反应生成硫酸铁和水,反应的离子方程式为:Fe2O3+6H+=2Fe3++3H2O,故答案为:Fe2O3+6H+=2Fe3++3H2O;
②. 判断铁屑是否洗净的方法是测最后一次洗涤液的pH,若为7,则说明铁屑已洗净,故答案为:测最后一次洗涤液的pH,若为7,则说明铁屑已洗净;
(2). pH调至2.5,是因为NO3-在酸性条件下的氧化性强,易被铁屑还原,故答案为:NO3-在酸性条件下的氧化性强,易被铁屑还原;
(3). ①. 根据图示可知,在t1时刻前,硝酸根离子、氢离子浓度逐渐减小,亚铁离子浓度增大,则在t1时刻前是金属铁和硝酸之间的反应,即4Fe+NO3-+10H+=4Fe2++NH4++3H2O,故答案为:4Fe+NO3-+10H+=4Fe2++NH4++3H2O;
②. 根据反应4Fe+NO3-+10H+=4Fe2++NH4++3H2O可知,溶液中NH4+的浓度在增大,Fe2+的浓度却没有增大,所以原因是生成的Fe2+水解所致,故答案为:生成的Fe2+水解;
(4). 构成原电池可以加快化学反应速率,炭粉和铁屑构成了无数微小的原电池加快反应速率,故答案为:炭粉和铁构成了无数微小的原电池加快反应速率。
点睛:本题主要考查硝酸、铁及其化合物的化学性质,试题难度中等。熟练掌握硝酸的化学性质和铁及其化合物的性质是解答本题的关键,本题的难点是第(3)问,解答本问时,需先仔细审图,根据图示得出t1时刻前,硝酸根离子、氢离子浓度是逐渐减小的,亚铁离子浓度是逐渐增大的,所以t1时刻前是金属铁和硝酸之间的反应,随着反应的进行,溶液中铵根离子浓度在增大,亚铁离子的浓度却没有增大,说明是生成的亚铁离子发生了水解反应,据此解答本题即可。
【题型】综合题
【结束】
18
【题目】含有K2Cr2O7的废水具有较强的毒性,工业上常用钡盐沉淀法处理含有K2Cr2O7的废水并回收重铬酸,具体的流程如下:
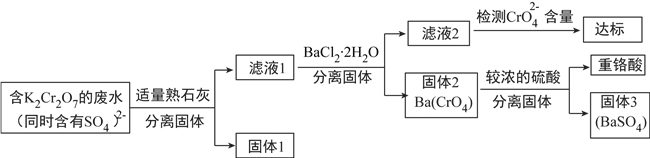
已知:CaCr2O7、BaCr2O7易溶于水,其它几种盐在常温下的溶度积常数如下表所示。
物质 | CaSO4 | CaCrO4 | BaCrO4 | BaSO4 |
溶度积 | 9.1×10-6 | 2.30×10-2 | 1.17×10-10 | 1.08×10-10 |
(1)用离子方程式表示K2Cr2O7溶液中同时存在K2CrO4的原因(将离子方程式补充完整):
![]() +__________=
+__________=![]() +__________。____________
+__________。____________
(2)向滤液1中加入BaCl2·2H2O的目的,是使![]() 从溶液中沉淀出来。
从溶液中沉淀出来。
①结合上述流程说明熟石灰的作用:__________。
②结合表中数据,说明选用Ba2+而不选用Ca2+处理废水的理由:__________。
③研究温度对![]() 沉淀效率的影响。实验结果如下:在相同的时间间隔内,不同温度下
沉淀效率的影响。实验结果如下:在相同的时间间隔内,不同温度下![]() 的沉淀率
的沉淀率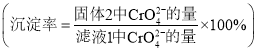 ,如下图所示。
,如下图所示。
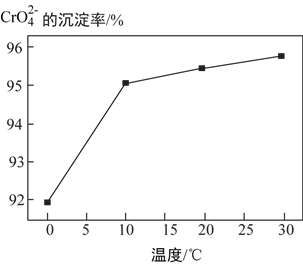
已知:BaCrO4(s) ![]() Ba2+(aq)+
Ba2+(aq)+ ![]() ΔH>0
ΔH>0
![]() 的沉淀效率随温度变化的原因是__________。
的沉淀效率随温度变化的原因是__________。
(3)向固体2中加入硫酸,回收重铬酸。
①硫酸浓度对重铬酸的回收率如下图所示。结合化学平衡移动原理,解释使用0.450mol/L的硫酸时,重铬酸的回收率明显高于使用0.225mol/L的硫酸的原因:__________。
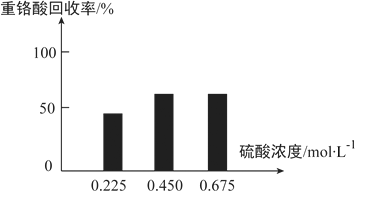
②回收重铬酸的原理如图所示。当硫酸浓度高于0.450mol/L时,重铬酸的回收率没有明显变化,其原因是__________。
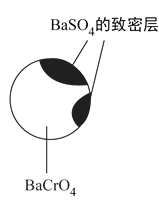
(4)综上所述,沉淀BaCrO4并进一步回收重铬酸的效果与__________有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.近年来甲醇用途日益广泛,越来越引起商家的关注,工业上甲醇的合成途径多种多样。现有实验室中模拟甲醇合成反应,在2 L 密闭容器内,400 ℃时反应:CO(g)+2H(g) ![]() CH3OH(g) △H<0,体系中n(CO)随时间的变化如表:
CH3OH(g) △H<0,体系中n(CO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 5 |
n(CO)(mol) | 0.020 | 0.011 | 0.008 | 0.007 | 0.007 |
(1)图中表示CH3OH 的变化的曲线是_______。

(2)用H2 表示从0~2s 内该反应的平均速率v(H2)=______。
(3)能说明该反应已达到平衡状态的是______。
a.v(CH3OH)=2v(H2) b.容器内压强保持不变
c.2V 逆(CO)= v 正(H2) d.容器内密度保持不变
(4) CH3OH 与O2的反应可将化学能转化为电能,其工作原理如右图所示,图中CH3OH 从______(填A 或B)通入, b 极的电极反应式是______。
II.某研究性学习小组为探究锌与盐酸反应,取同质量、同体积的锌片、同浓度盐酸做了下列平行实验:
实验①: 把纯锌片投入到盛有稀盐酸的试管中,发现氢气发生的速率变化如图所示:

实验②: 把纯锌片投入到含FeCl3 的同浓度工业稀盐酸中,发现放出氢气的量减少。
实验③: 在盐酸中滴入几滴CuCl2溶液,生成氢气速率加快。
试回答下列问题:
(1)试分析实验①中t1~t2速率变化的主要原因是_______________。 t2~t3速率变化的主要原因是______________。
(2)实验②放出氢气的量减少的原因是________。
(3)某同学认为实验③反应速率加快的主要原因是因为形成了原电池,你认为是否正确?_____ (填“正确”或“不正确”)。请选择下列相应的a或b作答。
a、若不正确,请说明原因:________________。
b、若正确则写出实验③中原电池的正极电极反应式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学利用下图所示装置进行铁的电化学腐蚀原理的探究实验:
装置 | 分别进行的操作 | 现象 |
| i. 连好装置一段时间后,向烧杯中滴加酚酞 | |
ii. 连好装置一段时间后,向烧杯中滴加K3[Fe(CN)6]溶液 | 铁片表面产生蓝色沉淀 |
(1)小组同学认为以上两种检验方法,均能证明铁发生了吸氧腐蚀。
①实验i中的现象是______。
②用电极反应式解释实验i中的现象:______。
(2)查阅资料:K3[Fe(CN)6]具有氧化性。
①据此有同学认为仅通过ii中现象不能证明铁发生了电化学腐蚀,理由是______。
②进行下列实验,在实验几分钟后的记录如下:
实验 | 滴管 | 试管 | 现象 |
| 0.5 mol·L-1 K3[Fe(CN)6]溶液 | iii. 蒸馏水 | 无明显变化 |
iv. 1.0 mol·L-1NaCl 溶液 | 铁片表面产生大量蓝色沉淀 | ||
v. 0.5 mol·L-1Na2SO4溶液 | 无明显变化 |
a. 以上实验表明:在有______存在条件下,K3[Fe(CN)6]溶液可以与铁片发生反应。
b. 为探究Cl-的存在对反应的影响,小组同学将铁片酸洗(用稀硫酸浸泡后洗净)后再进行实验iii,发现铁片表面产生蓝色沉淀。此补充实验表明Cl-的作用是______。
(3)有同学认为上述实验仍不够严谨。为进一步探究K3[Fe(CN)6]的氧化性对实验ii结果的影响,又利用(2)中装置继续实验。其中能证实以上影响确实存在的是______(填字母序号)。
实验 | 试剂 | 现象 |
A | 酸洗后的铁片、K3[Fe(CN)6]溶液(已除O2) | 产生蓝色沉淀 |
B | 酸洗后的铁片、K3[Fe(CN)6]和NaCl混合溶液(未除O2) | 产生蓝色沉淀 |
C | 铁片、K3[Fe(CN)6]和NaCl混合溶液(已除O2) | 产生蓝色沉淀 |
D | 铁片、K3[Fe(CN)6]和盐酸混合溶液(已除O2) | 产生蓝色沉淀 |
(4)综合以上实验分析,利用实验ii中试剂能证实铁发生了电化学腐蚀的实验方案是:连好装置一段时间后,取铁片(负极)附近溶液于试管中,_____(回答相关操作、现象),则说明负极附近溶液中产生了Fe2+,即发生了电化学腐蚀。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com