
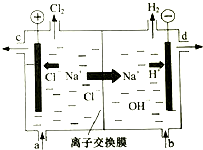
 工业中的氯碱工业是离子交换膜法电解精制饱和食盐水如下图,离子交换膜只允许阳离子通过.
工业中的氯碱工业是离子交换膜法电解精制饱和食盐水如下图,离子交换膜只允许阳离子通过.分析 (4)硫酸钡为沉淀;
(5)电解饱和食盐时阳极阴离子Cl-、OH-放电,Cl-的放电能力强于OH-,阳极发生的方程式为:2Cl--2e-═Cl2↑,阴极:2H++2e-═H2↑;H2、NaOH在阴极,NaOH溶液的出口为d,Cl2在阳极,精制饱和食盐水从阳极进入;
(6)Na2SO3属于强碱弱酸盐,亚硫酸根离子水解而使其溶液呈碱性,再结合电荷守恒判断离子浓度大小;
(7)酸的电离常数越大,酸性越强,其盐的水解程度越小.
解答 解:(4)由于硫酸钡为沉淀,故可以将SO42-转化为BaSO4沉淀而除去,由于不能引入新杂质或引入的新杂质在后续操作中可以除去,故应加入BaCl2或Ba(OH)2,故答案为:BaCl2或Ba(OH)2;
(5)电解槽中阴极是氢离子放电生成氢气,水电离平衡正向进行氢氧根离子浓度增大,生成氢氧化钠溶液,NaOH溶液的出口为d;
Cl2在阳极,依据装置图分析可知精制饱和食盐水从阳极进入,即进口为a,
故答案为:a,d;
(6)Na2SO3属于强碱弱酸盐,SO32-水解生成HSO3-、OH-而使其溶液呈碱性,水解方程式为:SO32-+H2O?HSO3-+OH-,钠离子不水解,所以c(Na+)最大,水和亚硫酸根离子水解都生成OH-,所以c(OH-)>c(HSO3-),c(H+) 最小,所以该溶液中离子浓度大小顺序是c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+),
故答案为:c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+);
(7)酸的电离常数越大,酸性越强,其盐的水解程度越小,由于HClO电离常数小于HSO3-的电离平衡常数,所以NaClO的水解程度较Na2SO3大,即浓度相同时NaClO溶液的pH大于Na2SO3 溶液的pH,故答案为:大于.
点评 本题考查了粗盐的提纯以及氯碱工业和盐溶液中的离子浓度大小比较、盐类的水解规律,应注意的是Na2SO3对应的酸是HSO3-.注意掌握“越弱越水解”的规律的应用.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 7.1g C12与足量NaOH溶液反应转移的电子数为0.2NA | |
| B. | 46 g NO2 和 N2O4混合气体中含有原子数为3NA | |
| C. | 1mol Na2O2 固体中含离子总数为4NA | |
| D. | 标准状况下,2.24L辛烷所含分子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | c(X2)=0.1mol•L-1 | B. | c(Y2)=0.3mol•L-1 | C. | c(X2)=0.2mol•L-1 | D. | c(Z)=0.3mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所得的分散系属于悬浊液 | |
| B. | 该分散系能产生丁达尔效应 | |
| C. | 所得的分散系中水是分散质 | |
| D. | 将所得分散系过滤,在滤纸上能得到分散质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向FeI2溶液中加入少量氯水2Fe2++Cl2=2Fe3++2Cl- | |
| B. | NaClO (aq) 中通入过量 SO2:C1O-+SO2+H2O=HClO+HSO3- | |
| C. | 氯气通入水中:Cl2+H2O=2H++Cl-+ClO- | |
| D. | 次氯酸钙溶液中通入少量CO2:Ca2++2ClO-+H2O+CO2=CaCO3↓+2 HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
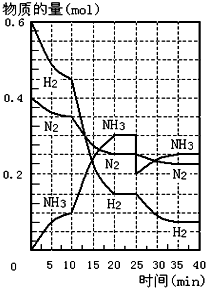 500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3的物质的量变化如图所示,根据题意完成下列各题:
500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3的物质的量变化如图所示,根据题意完成下列各题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com