
| A. | Na[Al(OH)4]溶液中通入过量CO2:2[Al(OH)4]-+CO2+3H2O=2Al(OH)3↓+CO32- | |
| B. | 往碳酸镁中滴加稀盐酸:CO32-+2H+═CO2↑+H2O | |
| C. | 氧化铜溶于稀盐酸中:CuO+2H+=Cu2++2H2O | |
| D. | 向Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
分析 A.二氧化碳过量反应生成碳酸氢钠;
B.碳酸镁为沉淀,应保留化学式;
C.氧化铜与盐酸反应生成氯化铜和水;
D.反应生成硫酸钡、硫酸钠和和水.
解答 解:A.Na[Al(OH)4]溶液中通入过量CO2,离子方程式:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,故A错误;
B.往碳酸镁中滴加稀盐酸,离子方程式:MgCO3+2H+═CO2↑+H2O+Mg2+,故B错误;
C.氧化铜溶于稀盐酸中,离子方程式:CuO+2H+=Cu2++2H2O,故C正确;
D.向Ba(OH)2溶液中滴加NaHSO4溶液至中性,反应离子方程式为:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,故D错误;
故选:C.
点评 本题考查了离子方程式的书写,明确反应实质,注意反应物用量对反应的影响,题目难度不大.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:解答题
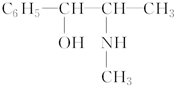
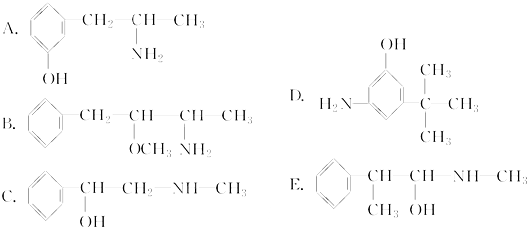
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 时间/s | 5 | 10 | 15 | 20 | 25 |
| n(CO2)/mol | 0.04 | 0.06 | 0.07 | 0.08 | 0.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
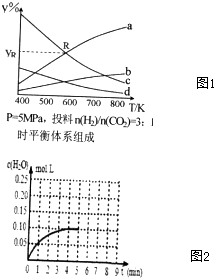 环境问题正引起全社会关注,CO、CO2的应用对构建生态文明有重要意义.
环境问题正引起全社会关注,CO、CO2的应用对构建生态文明有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ②③④⑤⑥⑦ | C. | ①②④⑤⑨ | D. | ①②③⑤⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应中的能量变化通常表现为热量的变化 | |
| B. | 化学键的断裂和形成是化学反应中能量变化的主要原因 | |
| C. | 吸热反应需要加热后才能发生 | |
| D. | 反应物总能量和生成物总能量的相对大小决定了反应是放出还是吸收能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 催化剂能使不起反应的物质发生反应 | |
| B. | 催化剂在化学反应前后,化学性质和质量都不变 | |
| C. | 催化剂不参加化学反应 | |
| D. | 任何化学反应,都需要催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com