
| 4.82g |
| 241g/mol |


科目:高中化学 来源: 题型:
| A、Fe(OH)3溶于氢碘酸中:Fe(OH)3+3H+=Fe3++3H2O |
| B、碳酸氢钠溶液与过量澄清石灰水反应:HCO3-+Ca2++OH-=CaCO3↓+H2O |
| C、硫酸亚铁溶液中加入酸化的双氧水:Fe2++2H++H2O2=Fe3++2H2O |
| D、向明矾溶液中滴加过量氨水:Al3++4NH3?H2O═AlO2-+4NH4++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
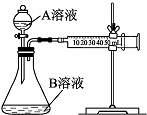 实验小组利用酸性KMnO4溶液与H2C2O4溶液反应研究影响反应速率的因素.
实验小组利用酸性KMnO4溶液与H2C2O4溶液反应研究影响反应速率的因素.查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验方案 (只要求填写选用试剂的序号) | 实验现象 | 结论 | |
| (1) | 一支试管中有白色沉淀,另一支试管中先生成白色沉淀,后白色沉淀消失. | 金属性:Mg>Al | |
| (2) | 非金属性: | ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验操作 | 实验现象或预期试验先行 | 现象解释(用离子方程式表示) | ||
| 猜想② | (1) | 溶液PH=8 | --- | |
| 向PH=2的硫酸中滴加Na2S2O3溶液 | (2) | S2O
| ||
| 猜想③ | 向新制氯水(PH<2)中滴加少许Na2S2O3溶液 | 氯水颜色变浅 | (3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
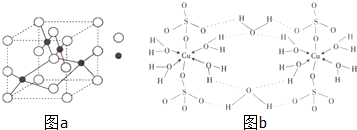
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com