

| | TiCl4 | Mg | MgCl2 | Ti |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
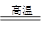 2FeCl3 + 2TiCl4 + 6CO (2分)
2FeCl3 + 2TiCl4 + 6CO (2分) TiO2·xH2O↓+ 4HCl △H﹥0加入大量水并加热,都能使水解反应向正反应方向进行,促进水解趋于完全。(3分)
TiO2·xH2O↓+ 4HCl △H﹥0加入大量水并加热,都能使水解反应向正反应方向进行,促进水解趋于完全。(3分) (2分)
(2分)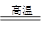 2FeCl3 + 2TiCl4 + 6CO ;
2FeCl3 + 2TiCl4 + 6CO ; TiO2·xH2O↓+ 4HCl,加入大量水并加热,HCl挥发,促使水解正向进行;
TiO2·xH2O↓+ 4HCl,加入大量水并加热,HCl挥发,促使水解正向进行; ;以甲醇和氧气(或空气)、电解液为Li2CO3和K2CO3的熔融物组成燃料电池,在电池工作时,CO32-移向负极。CH3OH在负极上失去电子,在CO32-的作用下生成CO2气体,O2在正极上得到电子,在CO2的作用下生成CO32-,其电极反应式为
;以甲醇和氧气(或空气)、电解液为Li2CO3和K2CO3的熔融物组成燃料电池,在电池工作时,CO32-移向负极。CH3OH在负极上失去电子,在CO32-的作用下生成CO2气体,O2在正极上得到电子,在CO2的作用下生成CO32-,其电极反应式为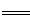 4CO2↑+2H2O
4CO2↑+2H2O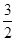 O2+6e-+3CO2
O2+6e-+3CO2 3CO32-
3CO32- 2FeCl3+2TiCl4+6CO可知,电解中生成的n(Cl2)=
2FeCl3+2TiCl4+6CO可知,电解中生成的n(Cl2)= n(CO)=
n(CO)=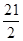 mol,根据2NaCl+2H2O
mol,根据2NaCl+2H2O  2NaOH+H2↑+Cl2↑可知,电解生成n(H2)=n(Cl2)=
2NaOH+H2↑+Cl2↑可知,电解生成n(H2)=n(Cl2)=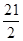 mol,故需额外补充H2为18mol-
mol,故需额外补充H2为18mol-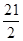 mol=7.5mol。
mol=7.5mol。

科目:高中化学 来源:不详 题型:单选题
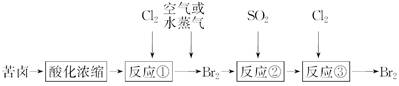
| A.反应①③的方程式相同,其目的也完全相同 |
| B.最好采用分液的方法从反应③后的溶液中分离出单质溴 |
| C.图示的工艺流程是一种没有任何缺陷的成熟技术 |
| D.至少需三步反应才能从苦卤中冶炼出金属镁 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 Ti+2MgCl2获得海绵状钛。该反应在下列哪种环境中进行_______ (填序号)。
Ti+2MgCl2获得海绵状钛。该反应在下列哪种环境中进行_______ (填序号)。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
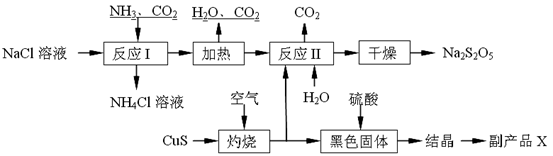
 Na2S2O5+H2O等多步反应。
Na2S2O5+H2O等多步反应。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
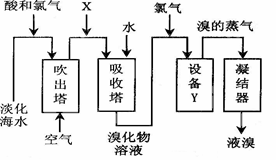
| A.X为SO2气体,也可将SO2换成Na2SO3 |
| B.设备Y为蒸馏塔 |
| C.在提取溴的过程中一定有Br-被氧化 |
| D.工业上每获得1molBr2,需要消耗Cl2的体积最多为22.4L(标准状态下) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
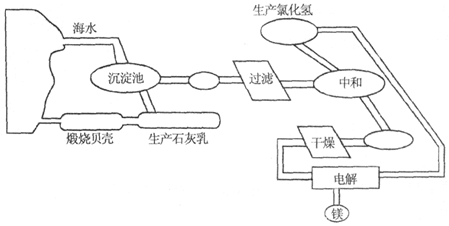
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题

| | SrSO4 | BaSO4 | Sr(OH)2 |
| Ksp | 3.3×10—7 | 1.1×10—10 | 3.2×10—4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com