
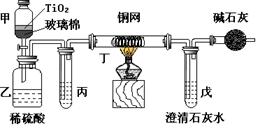
|


科目:高中化学 来源:不详 题型:填空题
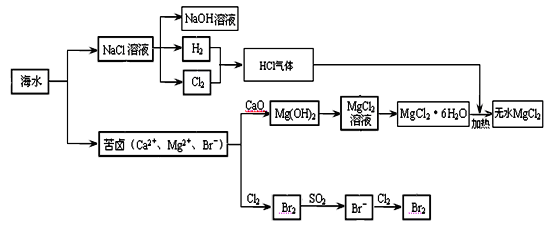
 MgCl2 + 6H2O,该反应要在HCl气流中进行,原因是 。
MgCl2 + 6H2O,该反应要在HCl气流中进行,原因是 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 混合物 | 试剂 | 分离方法 |
| A | 溴苯(溴) | 氢氧化钠 | 分液 |
| B | 乙烷(乙烯) | 酸性高锰酸钾 | 洗气 |
| C | 乙酸乙酯(乙酸) | 饱和碳酸钠 | 分液 |
| D | 乙醇(水) | 生石灰 | 蒸馏 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用矿盐生产食盐,除去SO42-最合适的试剂是Ba(NO3)2 |
| B.工业上通过电解氯化钠溶液制备金属钠和氯气 |
| C.室温下,AgCl在水中的溶解度小于在食盐中的溶解度 |
| D.用酚酞试液可鉴别饱和食盐水和饱和纯碱溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 序号 | A | B | C |
| 装置 |  |  |  |
| 原理 | 通入V升空气,测定生成沉淀的质量 | 当KMnO4溶液刚好褪色时,测定通入空气的体积V | 通入V升空气,测定U型管增加的质量 |

| 实验步骤 | 预期现象和结论 |
| | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
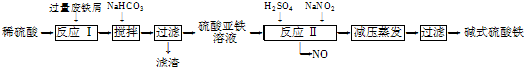
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.向某溶液中加入盐酸后产生能使澄清石灰水变浑浊的无色无味气体,则该溶液一定含有CO32- |
| B.向饱和Na2CO3溶液中通入足量的CO2后溶液变浑浊,是因为析出了NaHCO3晶体 |
| C.向某溶液中加入适量新制氯水和几滴KSCN溶液后呈红色,则该溶液一定含有Fe2+ |
| D.向某溶液中滴加BaCl2溶液后产生不溶于稀硝酸的白色沉淀,则该溶液一定含有Ag+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com