
科目:高中化学 来源: 题型:选择题
| A. | N2 | B. | O2 | C. | H2O | D. | CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 牙膏 | 两面针儿童牙膏 | 珍珠王防臭牙膏 | 中华透明牙膏 |
| 摩擦剂 | 氢氧化铝 | 碳酸钙 | 二氧化硅 |
| 摩擦剂的物质类别(指酸、碱、盐、氧化物、两性氢氧化物) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2LCO2与8.5gNH3所含分子数相等 | |
| B. | 等物质的量的H3O+和OH-质子数之比与电子数之比相同 | |
| C. | 常温常压下,48gO3和O2的混合气体中含有的氧原子数为3NA | |
| D. | 标准状况下,22.4LH2和Cl2的混合气体中含有的分子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 .
. +4NaOH$→_{△}^{H_{2}O}$
+4NaOH$→_{△}^{H_{2}O}$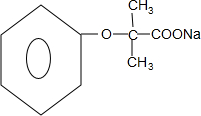 +3NaCl+2H2O.
+3NaCl+2H2O. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由同种元素组成的物质一定属于纯净物 | |
| B. | NaHCO3在水中电离:NaHCO3═Na++H++CO32- | |
| C. | 含金属元素的离子不一定都是阳离子 | |
| D. | 具有相同质子数的微粒都属于同种元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| $\frac{浓度}{(mol•{L}^{_1})}$ | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com