
����Ŀ����ϩ�ڴ����������¿ɷ���������Ӧ���䷴Ӧ����Ϊ��PdCl2+C2H4+H2O![]() Pd+2HCl+CH3CHO��Pd+2CuCl2 PdCl2+2CuCl��4CuCl+4HCl+O2 4CuCl2+2H2O������˵���������
Pd+2HCl+CH3CHO��Pd+2CuCl2 PdCl2+2CuCl��4CuCl+4HCl+O2 4CuCl2+2H2O������˵���������
A. �����ӿ췴Ӧ���ʵ�ԭ����ͨ���ı䷴Ӧ·�������˻��
B. �ô�������Ӧ���ܷ���ʽ��2C2H4+O2![]() 2CH3CHO
2CH3CHO
C. �ô��������̿�����ˮ�����½���
D. CuCl2��PdCl2�Ļ����Һ����Ϊ�÷�Ӧ�Ĵ���
���𰸡�C
��������
A. �������Ըı䷴Ӧ��·�����뷴Ӧ���γɻ�м�������·���������йء���ܵ���:Ea = ��м����������� - ��Ӧ���ƽ�������������ı�·��ʹ����������С������ܱ�С����A��ȷ��
B. ���ݷ�Ӧ������PdCl2��CuCl2Ϊ�÷�Ӧ�Ĵ���������Ӧ������ʽ�ϲ��ɵã��ô�������Ӧ���ܷ���ʽ��2C2H4+O2![]() 2CH3CHO����B��ȷ��
2CH3CHO����B��ȷ��
C. ���ݷ�Ӧ����PdCl2+C2H4+H2O![]() Pd+2HCl+CH3CHO���ô�����������ˮ���뷴Ӧ����C����
Pd+2HCl+CH3CHO���ô�����������ˮ���뷴Ӧ����C����
D. ���ݷ�Ӧ�������̣�PdCl2��CuCl2Ϊ�÷�Ӧ�Ĵ�������D��ȷ��
��ѡC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)��һ�������£�28.80g��������A��1.20molCl2��ɷ�Ӧ������1.20molAClx����x=__________����Aԭ�Ӻ�����������������������Aԭ�Ӻ���������Ϊ__________ ����ԭ�ӽṹʾ��ͼΪ____________��
(2)���а���3.4g���ڱ�״���������Ϊ____________�����е�ԭ�ӵ���ĿΪ_____ ��������ȫ������ˮ�����500mL��Һ������Һ�����ʵ���Ũ��Ϊ______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����һ����Ҫ�Ļ���ԭ�ϣ���ӡȾ���Ƹľ�ĺ�ũҵ����������Ҫ��;������Һ���ܺ���NH![]() ��Al3����SO
��Al3����SO![]() ��Fe2����Cl�������������ӣ�ijͬѧ��Ʋ����������ʵ�飺
��Fe2����Cl�������������ӣ�ijͬѧ��Ʋ����������ʵ�飺
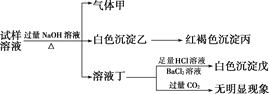
�������ϵ�ʵ�����������ͬѧ�ó��Ľ��۲���ȷ����(����)
A. ������Һ�п϶���NH![]() ��SO
��SO![]() ��Fe2��
��Fe2��
B. ������Һ��һ��û��Al3��
C. ��������ڱ�״�������Ϊ0.448 L���������ͳ�����ֱ�Ϊ1.07 g��4.66 g������ж�������Һ�л���Cl��
D. �����ڹ�ҵ�Ͽ���������ˮ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Cu2O���ھ��������Ĵ����ܶ��ܵ���ע���±�Ϊ��ȡCu2O�����ַ�����
����a | ��̿���ڸ��������»�ԭCuO |
����b | �������ǻ�ԭ���Ƶ�Cu(OH)2�Ʊ�Cu2O |
����c | ��ⷨ����ӦΪ2Cu+H2O |
����d | ����(N2H4)��ԭ���Ƶ�Cu(OH)2 |
��1����֪����2Cu��s��+![]() O2��g����Cu2O��s������H����169kJmol��1
O2��g����Cu2O��s������H����169kJmol��1
��C��s��+![]() O2��g����CO��g������H����110.5kJmol��1
O2��g����CO��g������H����110.5kJmol��1
��Cu��s��+![]() O2��g����CuO��s������H����157kJmol��1
O2��g����CuO��s������H����157kJmol��1
��a�������Ȼ�ѧ����ʽ�ǣ�_____��
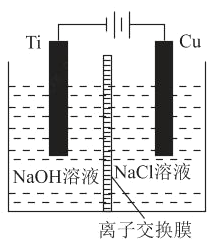
��2������c�������ӽ���Ĥ���Ƶ��Һ��OH����Ũ�ȶ��Ʊ�����Cu2O��װ����ͼ��ʾ��
�����ӽ���ĤΪ_____���ӽ���Ĥ�����������������������õ�ص�������ӦʽΪ_____���Ѽ�������pHֵ_____����������������С����������������
��3������dΪ������������Һ̬�£�N2H4����ԭ����Cu��OH��2���Ʊ�����Cu2O��ͬʱ�ų�N2�����Ʒ��Ļ�ѧ����ʽΪ_____��
��4������ͬ���ܱ������У������Ϸ����Ƶõ�����Cu2O�ֱ���д��ֽ�ˮ��ʵ�飺
2H2O��g��![]() 2H2��g��+O2��g����H��0��ˮ������Ũ����ʱ��t�仯���±���ʾ��
2H2��g��+O2��g����H��0��ˮ������Ũ����ʱ��t�仯���±���ʾ��
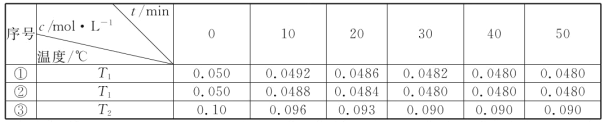
���Ա�ʵ����¶ȣ�T2_____T1�����������������������������ܷ�ͨ���Ա�ʵ���٢�����ƽ������ʱ�䳤���жϣ�_____����������������������
��ʵ����ǰ20min��ƽ����Ӧ���� v��O2����_____
�������Ĵ�Ч�ʣ�ʵ����_____ʵ��������������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ŀǰ�����Ϻ�ˮ��������Ҫ���������������������������ȡ�������������ֱ����Դ������ͨ�����ӽ���Ĥ�Ժ�ˮ���д���(ԭ����ͼ��ʾ)��������������ѹǿ��ʹ��ˮһ���ˮ����ͨ����Ĥ���뵭ˮһ�࣬�Ӷ��õ���ˮ��Ũ��������Һ(ԭ����ͼ��ʾ)������˵����ȷ����
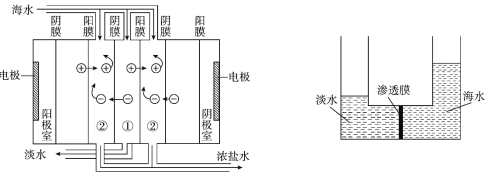
A. ������������������������������ѧ��Ӧ
B. ������������Ĥ����ֱ����Χ��1��100nm
C. �������豸���ɱ��͵��ŵ�
D. Ũ��������Һ��������ȡ���Ʊ�ʳ�Ρ�þ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���л����з���һ��������Ϊԭ�ϵ����ͻ�ѧ��Դ���õ�Դ�������缫�Ϸֱ�����ĺ�������������ԭ����ͼ��ʾ������˵����ȷ����
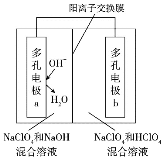
A. �缫a�Ϸ����ķ�ӦΪ��4OH-��4e-=O2��+2H2O
B. ��Դ����ʱ������������������Һ����ת��ΪNaClO4��Һ
C. ���ӴӶ�缫b�����������缫a
D. �õ�ԴͶ�����õ���Ҫ�ѹ��ǵͳɱ������Ĵ�����ȡ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͨ����ˮ��ɹ�ɵô��Σ����γ�NaCl�⣬������CaCl2��MgCl2��Na2SO4�Լ���ɳ�����ʣ��������Ʊ����ε�ʵ�鷽������������ͼ��
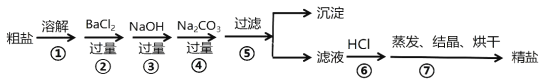
��1���ڢڲ�������Ŀ���dz�ȥ�����е�______________���� �ѧʽ����ͬ��
��2��ͼ�����������ijɷ��ǣ�____________��_____________��____________��_____________��
��3���ڢܲ�������Ŀ���dz�ȥ________________��_________________��д����Ӧ�����ӷ�Ӧ����ʽ��_______________________��_________________________��
��4���ڢ�������Ŀ����_________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��ѧ��ӦA2(g)��B2(g)��2AB(g)�������仯��ͼ��ʾ������������ȷ����
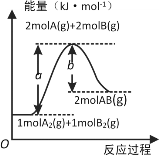
A. �γ�2molA��B��������b kJ����
B. ÿ����2����AB����bkJ����
C. ��Ӧ��������������������������
D. �÷�Ӧ����H����b��a��kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��D��E����Ԫ�ؾ�Ϊ������Ԫ�أ�ԭ������������AԪ��ԭ�ӵĺ�������������Ӳ�������������������ȡ�B��D��E����Ԫ�������ڱ������λ����ͼ����ʾ��ֻ��EԪ�صĵ�������ˮ��Ӧ���������ᡣ�ס��ҡ�M��W��X��Y��Z�������ʾ���A��B��D����Ԫ���е�һ�ֻ�����ɣ�����ֻ��M����ͬʱ��������Ԫ��;WΪN2H4���������ȼ�ϣ��ס���Ϊ�ǽ������ʣ�X�����к���10�����ӡ�����֮���ת����ϵ��ͼ����ʾ��
ͼ��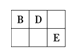 ͼ��
ͼ��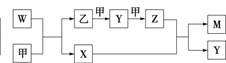
�ش���������:
(1)�������ɱ�״����1.12 L Y������9.025 kJ������д����Ӧ���Ȼ�ѧ����ʽ��________��
(2)һ����E�ĵ�����NaOH��Һǡ����ȫ��Ӧ��������Һ��pH__7(����������������������С����)��ԭ����____(�����ӷ���ʽ��ʾ)��
(3)W-����ȼ�ϵ����һ�ּ���ȼ�ϵ�أ��������Һ��20%~30%��KOH��Һ��W-����ȼ�ϵ�طŵ�ʱ��������ӦʽΪ_____��������ӦʽΪ______��
(4)��һ������A2��B2����������1 L�ܱ������У���500 �桢2��107 Pa�´ﵽƽ�⡣���ƽ������������ʵ���Ϊ0.50 mol������A2Ϊ0.3 mol��B2Ϊ0.1 mol�����������A2��ƽ��ת����Ϊ____,���¶��µ�ƽ�ⳣ��Ϊ____��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com