
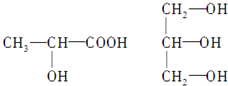
 ,
, ;
; ,
, .
.| 1 |
| 2 |


科目:高中化学 来源: 题型:
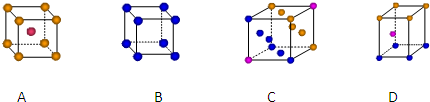
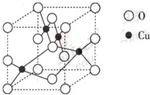
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、第三周期Ⅷ族,p区 |
| B、第三周期ⅤB族,ds区 |
| C、第四周期Ⅷ族,d区 |
| D、第四周期ⅤB族,f区 |
查看答案和解析>>
科目:高中化学 来源: 题型:
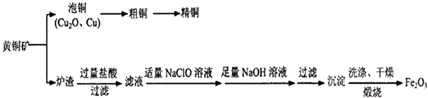
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、镁原子由1s22s22p63s2→1s22s22p63p2时,原子释放能量,由基态转化成激发态 |
| B、同一原子中,2p,3p,4p能级的轨道依次增多 |
| C、所有原子任一能层的s电子云轮廓图都是球形,但球的半径大小不同 |
| D、CH2O和ClO4-的中心原子上都含有孤对电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH4O与C2H6O一定互为同系物 |
| B、1mol C6H6(苯)中含有3mol碳碳双键 |
| C、用浓硝酸与蛋白质的颜色反应鉴别部分蛋白质 |
| D、向乙酸乙酯中加入NaOH 溶液,振荡,分液分离除去乙酸乙酯中的少量乙酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com