
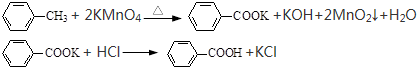

| 8×10-3mol×1mol |
| 1mol×0.025mol |
| 9.76g |
| 1.22og |


科目:高中化学 来源: 题型:
| A、洗净的锥形瓶和容量瓶可以放进烘箱中烘干 |
| B、用激光笔检验KI溶液中是否溶有淀粉 |
| C、配制硫酸亚铁溶液时,应将绿矾晶体溶于蒸馏水再加入一定量的铁粉 |
| D、用分液漏斗分离乙酸乙酯和饱和碳酸钠溶液时,应打开活塞,使乙酸乙酯缓慢流出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
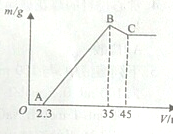 准确称取6g铝土矿样品(含Al2O3、Fe2O3、SiO2)放入盛有100mL某浓度硫酸溶液的烧杯中,充分反应后过滤,向滤液中加入10mol?L-1的NaOH溶液,产生的沉淀质量m与加入的NaOH溶液的体积V的关系如图所示.请回答下列问题:
准确称取6g铝土矿样品(含Al2O3、Fe2O3、SiO2)放入盛有100mL某浓度硫酸溶液的烧杯中,充分反应后过滤,向滤液中加入10mol?L-1的NaOH溶液,产生的沉淀质量m与加入的NaOH溶液的体积V的关系如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
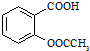 )是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备的基本操作流程如下:
)是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备的基本操作流程如下:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol?L-1 | 3×10-6 | 7×10-6 | 2×10-5 | 3×10-5 | 5×10-5 | 2×10-5 |
| c(NO2) |
| c(NO) |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蒸馏水 |
| B、饱和食盐水 |
| C、饱和氯化钾溶液 |
| D、75%的酒精溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
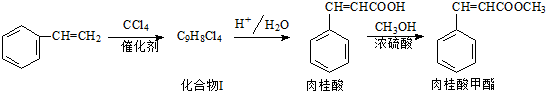
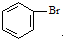 和CH=CHCOOH反应制得,该反应的反应类型是
和CH=CHCOOH反应制得,该反应的反应类型是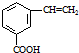 )是肉桂酸的同分异构体,下列有关化合物II和肉桂酸的说法正确的是
)是肉桂酸的同分异构体,下列有关化合物II和肉桂酸的说法正确的是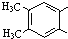 ,它在稀硫酸中能水解,且水解产物经聚合反应后得到高聚物.化合物Ⅲ有多种结构,写出其中一种的结构简式
,它在稀硫酸中能水解,且水解产物经聚合反应后得到高聚物.化合物Ⅲ有多种结构,写出其中一种的结构简式查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com