
| A. | agC2H4和C3H6的混合物所含碳氢键数目为$\frac{a{N}_{A}}{7}$ | |
| B. | 2.24L12C18O或14N2所含的电子数为1.4NA | |
| C. | 1L0.1mol/L的CuSO4溶液中含有Cu2+的数目为0.1NA | |
| D. | 25℃时,在PH=12的1.0LBa(OH)2溶液中含有OH-的数目为0.02NA |
分析 A.C2H4和C3H6的最简式为CH2,所以ag混合物中含有最简式CH2的物质的量为:$\frac{a}{14g/mol}$=$\frac{a}{14}$mol,在乙烯、丙烯和环丙烷分子中,平均每个碳原子形成一个碳碳键、每个氢原子形成一个碳氢键,据此计算出所含碳氢键数目;
B.气体的状况未知;
C.铜离子为弱碱阳离子,在水中部分水解;
D.根据pH=13,计算出C(H+)和C(OH-),然后根据溶液体积为1.0L来计算;
解答 解:A.每个氢原子形成1个碳氢键,ag混合物中总共含有$\frac{a}{7}$molH原子,所以含有$\frac{a}{7}$molH原子碳氢键,所含碳氢键数目为$\frac{a}{7}$NA,故A正确;
B.气体的状况未知,无法计算气体的物质的量,故B错误;
C.1L0.1mol/L的CuSO4溶液中含有0.1mol硫酸铜,铜离子为弱碱阳离子,在溶液中部分水解,Cu2+的数目小于0.1NA,故C错误;
D.溶液的pH=12,故C(H+)=10-12mol/L,可知C(OH-)=0.01mol/L,溶液体积为1.0L,故含有的氢氧根的物质的量为0.01mol,个数为0.01NA,故D错误;
故选:A.
点评 本题考查了阿伏伽德罗常数的判断及计算,题目难度中等,掌握公式的使用和物质的结构、气体摩尔体积使用条件和对象是解题关键.


 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:解答题
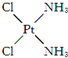 ,具有抗癌作用;反铂的结构简式为
,具有抗癌作用;反铂的结构简式为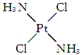 ,无抗癌作用.顺铂和反铂的物理性质有很大差异,其中只有一种易溶于水,请你通过所学知识判断哪一种易溶于水,并说明理由:顺式结构,顺铂易溶于水,因为它是极性分子,易溶于极性溶剂.
,无抗癌作用.顺铂和反铂的物理性质有很大差异,其中只有一种易溶于水,请你通过所学知识判断哪一种易溶于水,并说明理由:顺式结构,顺铂易溶于水,因为它是极性分子,易溶于极性溶剂.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 存在于O2、SO2和SO3中 | B. | 只存在于O2和SO3中 | ||
| C. | 只存在于O2和SO2中 | D. | 只存在于O2中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加强废旧塑料的回收与利用,能有效地治理白色污染 | |
| B. | 合成塑料、合成纤维、合成橡胶是三大合成材料 | |
| C. | 线型结构的塑料具有热塑性 | |
| D. | 塑料、纤维素、蛋白质、天然橡胶属于天然高分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
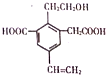
| A. | 1mol该物质,最多可以加成4molH2 | |
| B. | 该物质消耗Na、NaOH、NaHCO3的物质的量比为3:2:2 | |
| C. | 可以用酸性高锰酸钾溶液检验其中的碳碳双键 | |
| D. | 该物质能够在催化剂作用下被氧化为含醛基的化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com