
| A. | 铝粉与氧化铁在加热条件下的反应 | |
| B. | 灼热的碳与二氧化碳反应 | |
| C. | Ba(OH)2•8H2O晶体和NH4Cl晶体混合 | |
| D. | 碳与水高温条件下制取水煤气的反应 |
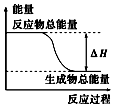
分析 从图上分析,反应物能量高于生成物,正反应是放热反应,常见的放热反应有:所有的物质燃烧、所有金属与酸反应、金属与水反应,所有中和反应;绝大多数化合反应和铝热反应;常见的吸热反应有:绝大数分解反应,个别的化合反应(如C和CO2),碳与水蒸气反应,碳、一氧化碳、氢气还原金属氧化物以及某些复分解(如铵盐和强碱),以此解答该题.
解答 解:反应物能量高于生成物,正反应是放热反应,
A.铝粉与氧化铁在加热条件下的反应为放热反应,故A正确;
B.灼热的碳与二氧化碳反应为吸热反应,故B错误;
C.Ba(OH)2•8H2O晶体和NH4Cl晶体的反应为吸热反应,故C错误;
D.碳与水高温条件下制取水煤气的反应为吸热反应,故D错误;
故选A.
点评 本题考查化学反应与能量的变化,为高频考点,侧重于学生的分析能力的考查,注意相关基础知识的积累,把握吸热反应和放热反应的类型,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 盐酸和氢氧化钠是工业上重要的化工原料,也是实验室里常见的试剂.
盐酸和氢氧化钠是工业上重要的化工原料,也是实验室里常见的试剂.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 主食 | 米饭、馒头 |
| 副食 | 烧鸡块、咸鸭蛋、红烧肉、花生米 |
| 饮料 | 牛奶 |
| 你的补充 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH溶液能导电,所以NaOH溶液是电解质 | |
| B. | 固体KC1不导电,但KC1是电解质 | |
| C. | 氯水能导电,所以Cl2是电解质 | |
| D. | CO2的水溶液能导电,所以CO2是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.05 mol•L-1 的 H2SO4 溶液 pH=1 | |
| B. | 0.001 mol•L-1 的 NaOH 溶液 pH=ll | |
| C. | 0.005 mol•L-1的H2SO4溶液与0.01 mol•L-1的NaOH溶液等体积混合,混合后溶液pH为5,溶液显酸性 | |
| D. | 完全中和pH=3的H2SO4溶液50 mL,需要PH=11的NaOH溶液50mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 CO↑+H2O.
CO↑+H2O.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某溶液中含有Ba2+,Mg2+,Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离.其流程图如图(已知溶液2为无色溶液)
某溶液中含有Ba2+,Mg2+,Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离.其流程图如图(已知溶液2为无色溶液)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com