
|
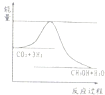
下图是温度和压强对反应2Z(g)
| |
| [ ] | |
A. |
上述可逆反应的正反应ΔH>0 |
B. |
X、Y必须均为气态物质 |
C. |
若要提高Z的转化率,可向反应体系中加入合适的催化剂 |
D. |
若保持恒温恒容的条件,向平衡体系中通入He,容器内压强增大,但正逆反应速率都不变 |
 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:阅读理解
| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2)/mol/L | 0.010 | 0.020 | 0.020 |
| c(CO2)/mol/L | 0.010 | 0.010 | 0.020 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

①配制浓度均为1 mol·L-1的盐酸和醋酸溶液;
②在广口瓶乙中装水,按图示连接好装置,检查装置的气密性;
③量取10.00 mL 1 mol·L-1的盐酸和醋酸溶液分别加入两套装置的锥形瓶中;
④称取两份质量均为a g的镁条(除去表面氧化膜、表面积相同),并固定于塑料杆末端;
⑤同时将塑料杆向下移动,使镁条浸入酸中至反应完全;
⑥反应结束后待温度恢复到室温,读出量筒中水的体积为V mL。
请根据上述步骤回答下列问题:
(1)用文字表述步骤②中检查该装置气密性的方法:_____________________。
(2)量取10.00 mL1mol·L-1盐酸和醋酸溶液分别注入锥形瓶中时,所用的仪器是_________(填下列各项序号字母)。
A.50 mL量筒 B.10 mL量筒
C.25 mL酸式滴定管 D.25 mL碱式滴定管
(3)步骤④中,理论上称取的镁条质量不能少于_________ g。
(4)步骤⑤中需记录的数据是_______;实验过程中观察到的主要现象是______________。
(5)步骤⑥中,读取量筒中水的体积时若俯视读数,对计算该条件下的气体摩尔体积影响为_________(填“偏大”“偏小”或“无法确定”)。
(6)为保证实验顺利进行,仪器丙应选用的规格是_________(填序号字母)。
A.100 mL B.200 mL C.500 mL
(7)若水蒸气的挥发影响忽略不计,在该温度和压强下,气体摩尔体积为______ L·mol-1。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省肇庆市高三上学期期末质量检测理综化学试卷(解析版) 题型:填空题
化工行业的发展必须符合国家节能减排的总体要求。请回答下列问题:
(1)已知C(s)+H2O(g)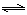 CO(g)+H2(g),则该反应的平衡常数表达式为 。
CO(g)+H2(g),则该反应的平衡常数表达式为 。
(2)已知在一定温度下,
C(s)+CO2(g)
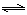 2CO(g)
△H1
2CO(g)
△H1
CO(g)+H2O(g)
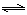 H2(g)+CO2(g)
△H2
H2(g)+CO2(g)
△H2
C(s)+H2O(g)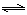 CO(g)+H2(g) △H3
CO(g)+H2(g) △H3
则△H1、△H2、△H3之间的关系是: 。
(3)通过研究不同温度下平衡常数可以解决某些实际问题。已知等体积的一氧化碳和水蒸气进入反应时,会发生如下反应: CO(g)+H2O(g) 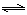 H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示。
H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示。
|
温度/℃ |
400 |
500 |
800 |
|
平衡常数K |
9.94 |
9 |
1 |
则该反应的正反应方向是 反应(填“吸热”或“放热”),在500℃时,若设起始时CO和H2O的起始浓度均为0.020mol/L,则CO的平衡转化率为 。
(4)从氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等。对反应N2O4(g) 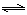 2NO2(g)
△H>0在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 :
2NO2(g)
△H>0在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 :
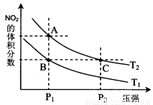
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态A到状态B,可以用加热的方法
E.A、C两点的化学平衡常数:A=C
(5)工业上用Na2SO3吸收尾气中的SO2,再用下图装置电解(惰性电极)NaHSO3制取H2SO4(阴离子交换膜只永许阴离子通过),阳极电极反应式为: ,阳极区逸出气体的成分为 (填化学式)。
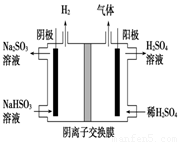
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
甲烷自热重整是先进的制氢方法,包含甲烷氧化和蒸汽重整。向反应系统同时通入甲烷、氧气和水蒸气,发生的主要化学反应有:
| 反应过程 | 化学方程式 | 焓变△H(kJ/mol) | 活化能Ea(kJ/mol) |
| 甲烷氧化 | CH4(g)+2O2(g)=CO2(g)+2H2O(g) | -802.6 | 125.6 |
| CH4(g)+O2(g)=CO2(g)+2H2(g) | -322.0 | 172.5 | |
| 蒸汽重整 | CH4(g)+H2O(g)=CO(g)+3H2(g) | 206.2 | 240.1 |
| CH4(g)+2H2O(g)=CO2(g)+4H2(g) | 165.0 | 243.9 |
回答下列问题:
(1)反应CO(g)+H2O(g)=CO2(g)+H2(g)的△H= kJ/mol。
(2)在初始阶段,甲烷蒸汽重整的反应速率 甲烷氧化的反应速率(填大于、小于或等于)。
(3)对于气相反应,用某组分(B)的平衡压强(PB)代替物质的量浓度(cB)也可表示平衡常数(记作KP),则反应CH4(g)+H2O(g)![]() CO(g)+3H2(g)的KP= ;
CO(g)+3H2(g)的KP= ;
随着温度的升高,该平衡常数 (填“增大”、“减小”或“不变”)。
(4)从能量角度分析,甲烷自热重整方法的先进之处在于 。
(5)在某一给定进料比的情况下,温度、压强对H2和CO物质的量分数的影响如下图:
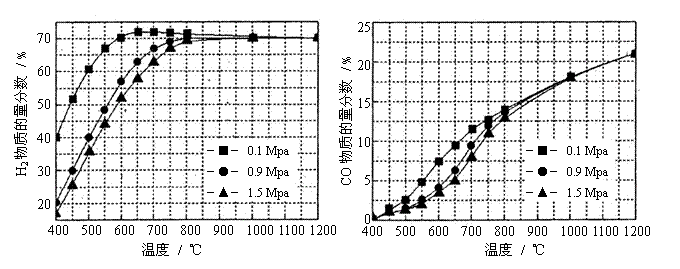
①若要达到H2物质的量分数>65%、CO的物质的量分数<10%,以下条件中最合适的是 。
A.600℃,0.9Mpa B.700℃,0.9MPa C.800℃,1.5Mpa D.1000℃,1.5MPa
②画出600℃,0.1Mpa条件下,系统中H2物质的量分数随反应时间(从常温进料开始计时)
的变化趋势示意图:

(6)如果进料中氧气量过大,最终导致H2物质的量分数降低,原因是 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省徐州市高三(上)期中化学试卷(解析版) 题型:解答题
| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2)/mo1/L | 0.010 | 0.020 | 0.020 |
| c(CO2)/moI/L | 0.010 | 0.010 | 0.020 |
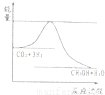
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com