
| A、电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-═Cl2↑ |
| B、氢氧燃料电池的负极反应式:O2+2H2O+4e-═4OH- |
| C、粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-═Cu2+ |
| D、钢铁发生电化学腐蚀的正极反应式:Fe-2e-═Fe3+ |


科目:高中化学 来源: 题型:
 已知:2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol
已知:2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol| 1 |
| 2 |
| A、CO的燃烧热为566kJ/mol |
| B、如图所示可表示由CO生成CO2的反应过程和能量关系 |
| C、2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)△H>-452kJ/mol |
| D、CO2(g)与Na2O2(s)反应放出452kJ热量时,电子转移数为6.02×1024(个) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | NaOH溶液的体积/ml | 盐酸的体积/ml | 溶液的pH |
| 1 | 20.00 | 0.00 | 8 |
| 2 | 20.00 | 20.00 | 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、密度:CCl4>CHCl3>H2O>苯 |
| B、沸点:戊烷>2,2一二甲基戊烷>2,3一二甲基丁烷>丙烷 |
| C、含氢量:甲烷>乙烯>乙炔>苯 |
| D、同物质的量物质燃烧耗O2量:环己烷>己烷>苯>苯甲酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、硫离子的结构示意图: |
B、NH4Cl的电子式: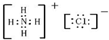 |
C、CO2的电子式: |
| D、次氯酸的结构式:H-O-Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)元素的第一电离能:N
(1)元素的第一电离能:N| 电离能 | I1 | I2 | I3 | I4 | … |
| In/kJ?mol-1 | 578 | 1817 | 2745 | 11575 | … |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com