
| 序号 | 滴定前读数 | 滴定后读数 |
| 1 | 0.00 | 20.01 |
| 2 | 1.00 | 20.99 |
| 3 | 0.00 | 21.10 |
分析 (1)根据配制溶液,及酸碱中和滴定所需要的试剂来分析;
(2)温度越高反应速率越快;高锰酸钾具有强氧化性,能将草酸氧化为二氧化碳,本身被还原为锰离子,据此书写方程式;
(3)②酸性溶液只能盛放在酸式滴定管中,锰离子有催化作用而导致反应速率加快,当滴入最后一滴高锰酸钾溶液,锥形瓶内的颜色恰好变成紫红色且半分钟不变化,证明达到终点;
③平均值等于消耗高锰酸钾的总体积与次数的比值,根据高锰酸钾和草酸之间的关系式计算;
④根据C=$\frac{n}{V}$判断不当操作对n或V的影响判断.
解答 解:(1)在配制氢氧化钠溶液时需要蒸馏水,在酸碱中和滴定的过程中,需要的试剂有酸液、碱液和酸碱指示剂,故还需要的是蒸馏水和酸碱指示剂,
故答案为:蒸馏水和指示剂;
(2)温度越高反应速率越快,A试管置于热水中,则A中的反应速率快,则褪色所用时间短,所以褪色所需时间tA<tB;高锰酸钾具有强氧化性,能将草酸氧化为二氧化碳,本身被还原为锰离子,即2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,
故答案为:<;2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
(3)②酸性溶液只能盛放在酸式滴定管中,所以酸性高锰酸钾溶液应该盛放在酸式滴定管中,高锰酸根离子被还原生成的锰离子有催化作用而导致反应速率加快,当滴入最后一滴高锰酸钾溶液,锥形瓶内的颜色恰好变成紫红色且半分钟不变化,证明达到终点,
故答案为:酸式;反应中生成的Mn2+有催化作用;滴入最后一滴溶液,由无色变为浅紫色,且半分钟内不褪色;
③第三次消耗体积与第一次和第二次相差较大,所以要舍去,则消耗KMnO4溶液的平均体积=$\frac{(20.10-0.00)+(20.90-1.00)}{2}$mL=20.00mL,
设样品的纯度为x,
5H2C2O4 +2MnO4-+6H+=10CO2↑+2Mn2++8H2O
450g 2mol
5.0x×$\frac{1}{10}$g (0.1×0.020)mol
x=$\frac{0.1×0.020×450}{2×5.0×0.1}$×100%=90.00%,
故答案为:20.00;90.00%;
④A.酸式滴定管水洗后未用待测液润洗,会导致酸性高锰酸钾浓度偏小,需要高锰酸钾体积偏大,测定值偏大,故A正确;
B.锥形瓶内有水,对实验无影响,故B错误;
C.定管尖嘴部分有气泡,滴定后消失,会导致测定高锰酸钾体积偏大,测定值偏大,故C正确;
D.观察读数时,滴定前仰视,滴定后俯视,导致测定高锰酸钾体积偏小,测定值偏小,故D错误;
故答案为:AC.
点评 本题考查了探究物质的组成及其含量的测定及中和滴定原理的应用,难度较大,注意把握实验基本方法,能会分析导致误差的不当操作,注意把握实验操作要点和注意事项.


 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:填空题
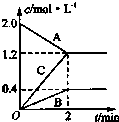 如图表示的是在800℃时,含有A、B、C三种气体的体系中各物质浓度随时间变化的情况,请回答:
如图表示的是在800℃时,含有A、B、C三种气体的体系中各物质浓度随时间变化的情况,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在制备乙烯的实验中,加热时应使温度缓慢上升至170°C | |
| B. | 在苯酚溶液中滴入少量稀溴水出现白色沉淀 | |
| C. | 将溴乙烷滴入NaOH溶液中,待充分反应再加入AgNO3溶液后有浅黄色沉淀生成 | |
| D. | 将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Li是负极,电极反应为Li+e-=Li+ | |
| B. | Li是正极,电极反应为Li+e-=Li- | |
| C. | MnO2是负极,电极反应为MnO2+e-=MnO2- | |
| D. | 锂电池是一种环保型电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2在正极发生氧化反应 | |
| B. | 供电时的总反应为:2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O | |
| C. | 氢氧燃料电池中H2和O2燃烧放出的热量转变为电能 | |
| D. | 氢氧燃料电池产物是水,属于环境友好电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (代号DMP)是一种常用的酯类塑化剂,其蒸气对氢气的相对密度为97.工业上生产DMP的流程如图所示:
(代号DMP)是一种常用的酯类塑化剂,其蒸气对氢气的相对密度为97.工业上生产DMP的流程如图所示:
 的名称1,2-二甲苯(或邻二甲苯),D的核磁共振氢谱有3组峰,DMP的分子式为C10H10O4.
的名称1,2-二甲苯(或邻二甲苯),D的核磁共振氢谱有3组峰,DMP的分子式为C10H10O4.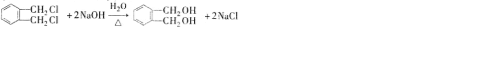 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Na<Mg | B. | 热稳定性:HCl>H2S | ||
| C. | 酸性强弱:H2SiO3<H2CO3 | D. | 碱性强弱:NaOH>Mg(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题



查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com