
| A、该溶液中,K+、Fe2+、C6H5OH、Br-可以大量共存 |
| B、和KI溶液反应的离子方程式:Fe3++2I-═Fe2++I2 |
| C、和Ba(OH)2溶液反应的离子方程式:Fe3++SO42-+Ba2++3OH-═Fe(OH)3↓+BaSO4↓ |
| D、1L O.1mol?L-1该溶液和足量的Zn充分反应,生成11.2g Fe |


科目:高中化学 来源: 题型:
| A、KMnO4、FeCl3、Cl2、CuCl2 |
| B、Cl2、FeCl3、KMnO4、CuCl2 |
| C、KMnO4、Cl2、FeCl3、CuCl2 |
| D、CuCl2、FeCl3、Cl2、KMnO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、砹单质为有色固体,易溶于有机溶剂 |
| B、HAt十分稳定 |
| C、AgAt为有色的、难溶于水的盐 |
| D、NaAt易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、胶体区别于其他分散系的本质特征是丁达尔现象 |
| B、利用滤纸可除去淀粉胶体中的少量NaCl |
| C、Fe(OH)3胶体带正电荷 |
| D、将直径为1~100纳米的Fe3O4颗粒均匀分散到水中,将得到Fe3O4胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、瑞典化学家舍勒命名了氯元素 |
| B、英国物理学家卢瑟福提出了带核的原子结构模型 |
| C、汤姆生发现电子打破了原子是不可分割的说法 |
| D、德国化学家维勒揭开了人工合成有机物的序幕 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢键比分子间作用力强,所以它属于化学键 |
| B、因为液态水中存在氢键,所以水比硫化氢稳定 |
| C、氨溶于水后氨分子与水分子之间形成氢键 |
| D、邻羟基苯甲醛的熔点比对羟基苯甲醛的熔点高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C为非气态 |
| B、平衡向逆反应方向移动 |
| C、D的体积分数变小 |
| D、A的转化率变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、异丁烷的结构式: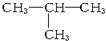 | ||
B、S2-的结构示意图: | ||
C、O-18的原子符号:
| ||
| D、CO2分子的结构式:O=C=O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.00mol NaCl中含有6.02×1023个NaCl分子 |
| B、1.00mol NaCl中,所有Na+的最外层电子总数为8×6.02×1023 |
| C、欲配置1.00L,1.00mol.L-1的NaCl溶液,可将58.5g NaCl溶于1.00L水中 |
| D、用量筒取5.00mL 1.00mol?L-1盐酸于50 mL容量瓶中,加水稀释至刻度,可配制0.100mol?L-1盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com