
【题目】减少氮氧化物和硫氧化物在大气 中的共放是环境保护的重要内容之一。
(1).已知:N2(g)+O2(g)=2NO (g) △H=+180.5kJ/mol
C(s )+ O2(g)=CO2(g) △H =-393.5kJ/mo1
2C(s)+ O2(g) =2CO(g) △H=-221kJ/mol
若某反应平衡常数表达式为: k=[c(N2)·c2(CO2)]/[c2(NO)·c2(CO)],请写出此反应的热化学方式________________________。
(2)N2O4在一定条件下可发生分解: 2 N2O5(g)![]() 4NO2(g) +O2 (g)。某温度下测得恒容密闭容器中N2O4浓度随时间的变化如下表:
4NO2(g) +O2 (g)。某温度下测得恒容密闭容器中N2O4浓度随时间的变化如下表:
t /min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
c(N0)/(mol/L) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
①反应开始时体系压强为P0第3.00min时体系压强为P1,则P1:P0 =__________2.00min~5.00min 内,O2的平均反应速率为________________。
②一定温度下,在恒容密闭容器充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是________。
a.容器中压强不再变化 b.NO2和O2 的体积比保持不变
c.2V正( NO2)=v逆(N2O5) d.气体的平均相对分子质量为43.2.且保持不变
(3)活性炭还原NO2的反应为: 2NO2(g)+2C (s)![]() N2(g)+2CO2(g),在恒温条件下,1mo1NO2和足量活性炭发生该反应,测得平衡时NO2和CO2的物质量浓度与平衡总压的关系如图所示:①A、B、C 三点中NO2的转化率最高约是_____点(填“A”、“B”或“C”)。
N2(g)+2CO2(g),在恒温条件下,1mo1NO2和足量活性炭发生该反应,测得平衡时NO2和CO2的物质量浓度与平衡总压的关系如图所示:①A、B、C 三点中NO2的转化率最高约是_____点(填“A”、“B”或“C”)。
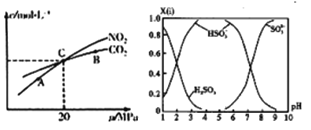
②计算C点时该反应的压强平衡常数Kp=_________MPa (K用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)直接排放含SO2的烟气会形成酸雨,危害环境。可月NaOH吸收,所得含硫各微粒(H2SO3 、HSO3-利SO32- )存在于反应后的溶被中,它们的物质量分数X(i)与溶液pH的关系如图所示。
若是与0.lmol/LNaOH 反应后的溶液,现得溶液为pH=8时,溶液中各离子浓度由大到小的顺序是____________________。
(5)实验狈得NH4HSO3溶液中,![]() ,则溶液的pH为_____;向该溶液中加氨水使溶液呈中性时,
,则溶液的pH为_____;向该溶液中加氨水使溶液呈中性时,![]() =______________。(已知: H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)。
=______________。(已知: H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)。
【答案】 2NO(g)+ 2CO(g)![]() N2(g)+2CO2(g) △H=-746.5kJ/mol 1.975:1 0.055mol/(L·min) a A 4 c(Na+)>c(SO32-)>c(HSO3-)>c(OH-) >c(H+) 5 3
N2(g)+2CO2(g) △H=-746.5kJ/mol 1.975:1 0.055mol/(L·min) a A 4 c(Na+)>c(SO32-)>c(HSO3-)>c(OH-) >c(H+) 5 3
【解析】(1).反应物及化学计量数为:2NO,2CO生成物及化学计量数为:N2,2CO2;反应热化学方程式为:2NO(g)+ 2CO(g)![]() N2(g)+2CO2(g),△H =2△H2-△H3-△H1=-746.5kJ/mol;
N2(g)+2CO2(g),△H =2△H2-△H3-△H1=-746.5kJ/mol;
(2). ①设容器体积为1L,则初始N2O4的量为1mol,3min后N2O4为0.35mol,生成NO21.3mol,O2为0.325mol,则P1:P0=n1:n0=1.975:1;2min时c(O2)=0.25 mol/L, 5min时c(O2)=0.415 mol/L,所以v(O2)=0.0.165/3 mol/(L·min)=0.055 mol/(L·min);②a.由于方程两端气体体积不同,所以当容器中压强不再发生变化时,反应达到平衡,a正确;b.两者体积比为定值,b错误;c.应该为:V正(NO2)=2v逆(N2O5) ,c错误;d. 气体的平均相对分子质量保持不变,反应平衡,但平均相对分子质量不一定为43.2,d错误。故选择a。
(3). ①容器内压强变大,有利于逆反应进行,所以压强最小的A点NO2的转化率最高;②设反应平衡时NO2消耗xmol,则此时容器中气体的物质的量为NO2(1-xmol),N2(x/2mol),CO2(xmol),由C点c(NO2)= c(CO2)得x=1/2,所以Kp=20*0.25/1.25 MPa =4 MPa;
(4). pH=8时,根据图示得到溶液为烟硫酸钠和亚硫酸氢钠的混合物,c(SO32-)>c(HSO3-),所以各离子浓度由大到小的顺序为c(Na+)>c(SO32-)>c(HSO3-)>c(OH-) >c(H+);
(5).![]() ,
,![]() ,Ka1·Ka2=15·c2(H+)=1.5×10-9,得出c(H+)=1.0×10-5mol/L,则pH=5;根据电荷守恒得c(NH4+)+ c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),由溶液pH=7得c(H+)= c(OH-),则c(NH4+)=2c(SO32-)+c(HSO3-),由
,Ka1·Ka2=15·c2(H+)=1.5×10-9,得出c(H+)=1.0×10-5mol/L,则pH=5;根据电荷守恒得c(NH4+)+ c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),由溶液pH=7得c(H+)= c(OH-),则c(NH4+)=2c(SO32-)+c(HSO3-),由![]() 得
得![]() 。
。


科目:高中化学 来源: 题型:
【题目】25℃时,下列有关溶液中粒子的物质的量浓度关系正确的是
A. 0.1 mol·L-1 Na2CO3与0.l mol·L-1 NaHCO3溶液等体积混合:2/3 c(Na+) = c(CO32-) + c(HCO3-) + c(H2CO3)
B. 0.1 mol·L-1 Na2C2O4与0.1 mol·L-1 HCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+)
C. 0.1 mol·L-1 CH3COONa与0.l mol·L-1 HCl 溶液等体积混合:c(Na+) = c(Cl-) > c(OH-) > c(CH3COO-)
D. 0.l mol·L-1 NH4Cl与0.l mol·L-1氨水等体积混合(pH > 7): c(NH3·H2O) > c(NH4+) > c(Cl-) > c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图所示装置及药品制取氨气。

(1)A中制氨气的化学方程式是______。
(2)B中碱石灰的作用是______。
(3)C处是用集气瓶收集氨气的装置,请绘出装置图。______
(4)证明氨气已集满的操作和现象是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质之间通过一步就能实现如图所示转化的是( )
物质编号 | 物质转化关系 | a | b | c | d |
① |
| Na2O | Na2O2 | Na | NaOH |
② | Al2O3 | NaAlO2 | Al | Al(OH)3 | |
③ | FeCl2 | FeCl3 | Fe | CuCl2 | |
④ | Si | SiO2 | Na2SiO3 | H2SiO3 |
A. ①② B. ②③ C. ②④ D. ①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一氧化碳是一种用途广泛的化工基础原料。有机物加氢反应中镍是常用的催化剂。但H2中一般含有微量CO会使催化剂镍中毒,在反应过程中消除CO的理想做法是投入少量SO2,为弄清该方法对催化剂的影响,查得资料如下:

则:(1)① 不用通入O2氧化的方法除去CO的原因是 ______________________________。
②SO2(g)+2CO(g)===S(s)+2CO2(g) ΔH=________。
(2)工业上用一氧化碳制取氢气的反应为:CO(g)+H2O(g) ![]() CO2(g)+H2(g),已知420 ℃时,该反应的化学平衡常数K=9。如果反应开始时,在2 L的密闭容器中充入CO和H2O的物质的量都是0.60 mol,5 min末达到平衡,则此时CO的转化率为________,H2的平均生成速率为________ mol·L-1·min-1。
CO2(g)+H2(g),已知420 ℃时,该反应的化学平衡常数K=9。如果反应开始时,在2 L的密闭容器中充入CO和H2O的物质的量都是0.60 mol,5 min末达到平衡,则此时CO的转化率为________,H2的平均生成速率为________ mol·L-1·min-1。
(3)为减少雾霾、降低大气中有害气体含量, 研究机动车尾气中CO、NOx及CxHy的排放量意义重大。机动车尾气污染物的含量与空/燃比 (空气与燃油气的体积比)的变化关系示意图如图所示:
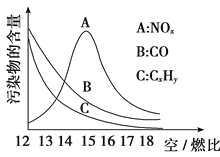
①随空/燃比增大,CO和CxHy的含量减少的原因是_____________________________。
②当空/燃比达到15后,NOx减少的原因可能是____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研小组以难溶性钾长石(K2O·Al2O3·6SiO2)为原料,提取Al2O3、K2CO3等物质,工艺流程如下:

(1)“煅烧”过程中有如下反应发生:
①钾长石中的硅元素在CaCO3作用下转化为CaSiO3,写出SiO2转化为CaSiO3的化学方程式: __________。
②钾长石中的钾元素和铝元素在Na2CO3作用下转化为可溶性的NaAlO2和KAlO2,写出Al2O3转化为NaAlO2的化学方程式:____________________________________。
(2)“转化”时加入NaOH的主要作用是________________________(用离子方程式表示)。
(3)上述工艺中可以循环利用的主要物质是________________、_________________和水。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写及评价均合理的是( )
选项 | 离子方程式 | 评价 |
A | 将2 mol Cl2通入含1 mol FeI2的溶液中: 2Fe2++2I-+2Cl2===2Fe3++4Cl-+I2 | 正确;Cl2过量,可将Fe2+、I-均氧化 |
B | Ba(HCO3)2溶液与足量的NaOH溶液反应: Ba2++HCO3-+OH-===BaCO3↓+H2O | 正确;酸式盐与碱反应生成正盐和水 |
C | 过量SO2通入NaClO溶液中: SO2+H2O+ClO-===HClO+HSO3- | 正确;说明酸性:H2SO3强于HClO |
D | 1 mol/L的NaAlO2溶液和2.5 mol/L的HCl溶液等体积混合: 2AlO2-+5H+===Al3++Al(OH)3↓+H2O | 正确;第一步反应和第二步反应消耗的H+的物质的量之比为2∶3 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H是一种新型香料的主要成分之一,其合成路线如下(部分产物和部分反应条件略去):
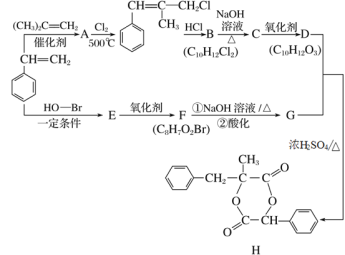
已知:①RCH=CH2+CH2==CHR′![]() CH2=CH2+RCH=CHR′;
CH2=CH2+RCH=CHR′;
②B中核磁共振氢谱图显示分子中有6种不同环境的氢原子。
请回答下列问题:
(1)(CH3)2C=CH2的同分异构体中存在顺反异构的有机物的名称为________。
(2)A的核磁共振氢谱除苯环上的H外,还显示________组峰,峰面积比为________。
(3)D分子中含有的含氧官能团名称是________,E的结构简式为__________________。
(4)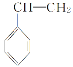 发生加聚反应的化学方程式为____________________________;D和G反应生成H的化学方程式为_________________________________________。
发生加聚反应的化学方程式为____________________________;D和G反应生成H的化学方程式为_________________________________________。
(5)G的同分异构体中,同时满足下列条件的有________种(不包括立体异构)。
①苯的二取代物 ②与FeCl3溶液发生显色反应 ③含“-COO-”结构
(6)参照上述合成路线,以丙烯为原料(无机试剂任选),设计制备2,3-丁二醇的合成路线_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 淀粉和纤维素在酸催化下完全水解后的产物都是葡萄糖
B. 乙醛和丙烯醛(![]() )不是同系物,它们与氢气充分反应后的产物也不是同系物
)不是同系物,它们与氢气充分反应后的产物也不是同系物
C. 乳酸薄荷醇酯(![]() )仅能发生水解、氧化、消去反应
)仅能发生水解、氧化、消去反应
D. 现代化学分析中,可采用质谱法来确定有机物分子中的官能团
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com