
| A. | CH4 | B. | BF3 | C. | CO2 | D. | N2 |
分析 一般不同种非金属性元素之间形成极性键;对于ABn的共价化合物,各元素满足|化合价|+元素原子的最外层电子数=8,原子都满足最外层8电子结构,在化合物中氢原子属于2电子稳定结构,据此结合选项判断.
解答 解:A.CH4中存在C-H极性键,CH4中C原子满足8电子结构;H原子不满足8电子结构,不符合题意,故A错误;
B.BF3中存在B-F极性键,B元素化合价为+3,B原子最外层电子数为3,所以3+3=6,分子中B原子不满足8电子结构,故B错误;
C.CO2中存在C-O极性键,CO2中C元素化合价为+4,C原子最外层电子数为4,所以4+4=8,分子中C原子满足8电子结构;O元素化合价为-2,O原子最外层电子数为6,所以|-2|+6=8,分子中O原子满足8电子结构,故C正确;
D.氮气分子中存在N≡N非极性键,故D错误;
故选C.
点评 本题考查了原子核外电子排布、共价键类型,题目难度不大,注意掌握极性共价键和非极性共价键的区别及分子中原子最外层8电子稳定结构的判断方法,试题培养了学生的分析能力及灵活应用能力.


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
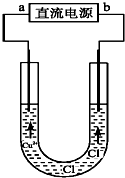
| A. | a端是直流电源的负极 | |
| B. | 阴极附近Cu2+浓度增大 | |
| C. | 阳极有铜析出 | |
| D. | 通电一段时间后,在阴极附近观察到黄绿色气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
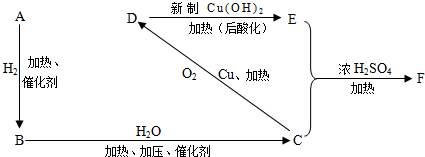
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 充电电池可以无限制的反复充电、放电 | |
| B. | 充电电池的化学原理是氧化还原反应 | |
| C. | 较长时间不使用电器时,最好将电器中电池取出,并妥善存放 | |
| D. | 充电是放电时的氧化还原反应逆向进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com