
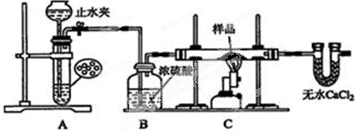
分析 (1)仪器组装完成后,夹好止水夹,在长颈漏斗中加水形成一段水柱,且不发生变化证明气密性完好;
(2)依据反应原理和物质性质分析判断,硝酸、浓硫酸和金属反应不能生成大量氢气;
(3)打开止水夹生成氢气,通过后续装置充满氢气排出装置中的空气后,检验气体纯度,收集检验氢气纯度,气体纯净后点燃C处的酒精喷灯,反应完成熄灭C处的酒精喷灯,待C处冷却至室温后,关闭止水夹,防止生成的铜被空气中氧气氧化;
(4)收集氢气验纯时,最好采用排水取气法收集;
(5)取少量样品于试管中,加入适量的稀硫酸,若无红色物质生成,可能是铁离子溶解生成的红色铜,另取少量样品于试管中,加入适量的浓硝酸,产生红棕色的气体,氧化亚铜的氧化性大于硫离子,证明样品中一定含有Cu2O,氧化亚铜和浓硝酸反应生成硝酸铜,二氧化氮和水;取少量上述的溶液,因为氧化亚铜反应生成硫酸铜溶液,加适量蒸馏水稀释后,依据铁离子和硫氰酸钾溶液反应生成血红色溶液分析设计;
(6)2Fe3++Cu=Cu2++2Fe2+,Cu2O+2H+═Cu+Cu2++H2O,固体为铜,铁离子全部反应生成亚铁离子,结合化学方程式定量关系计算得到.
解答 解:(1)仪器组装完成后,夹好止水夹,在长颈漏斗中加水形成一段水柱,且不发生变化证明气密性完好,向装置A中的长颈漏斗内注入液体至形成一段液注,若液柱高度保持不变;
故答案为:向装置A中的长颈漏斗内注入液体至形成一段液注,若液柱高度保持不变;
(2)由反应原理和物质性质可知,稀酸和锌反应生成氢气,金属铝和强碱溶液反应生成氢气;
A.稀硫酸和锌片反应生成硫酸锌和氢气,故A符合;
B.稀硝酸和铁片反应生成硝酸铁、一氧化氮和水,不能生成氢气,故B不符合;
C.氢氧化钠溶液和铝片反应生成偏铝酸钠和氢气,故C符合;
D.浓硫酸和镁片反应生成硫酸镁、二氧化硫和水,故D不符合;
故答案为:AC;
(3)氢气混有空气加热发生爆炸,所以开始先通氢气,打开止水夹生成氢气,通过后续装置充满氢气,目的是排出装置中的空气,检验最后U型管出来的气体氢气纯度,气体纯净后再点燃C处的酒精喷灯,反应完成后先撤酒精灯,玻璃管冷却再停氢气,操作位熄灭C处的酒精喷灯,待C处冷却至室温后,关闭止水夹,防止生成的铜被空气中氧气氧化,正确的存在顺序为:①⑥⑤④②③;
故答案为:⑥⑤④②;
(4)收集氢气验纯时,最好采用排水取气法收集,这样收集到的气体纯净;
故答案为:排水法;
(5)取少量样品于试管中,加入适量的稀硫酸,若无红色物质生成,可能是铁离子溶解生成的红色铜,不能证明样品中不含Cu2O,反应的离子方程式为:2Fe3++Cu=2Fe2++Cu2+;另取少量样品于试管中,加入适量的浓硝酸,产生红棕色的气体,氧化亚铜的氧化性大于硫离子,证明样品中一定含有Cu2O,氧化亚铜和浓硝酸反应生成硝酸铜,二氧化氮和水,反应的化学方程式为:Cu2O+6HNO3(浓)=2Cu(NO3)2+2NO2↑+3H2O;取少量上述中的溶液,因为氧化亚铜反应生成硝酸铜溶液,加适量蒸馏水稀释后,依据铁离子和硫氰酸钾溶液反应生成血红色溶液分析设计,若加入硫氰酸钾溶液变红色,证明含有铁离子,否则不含有铁离子;
故答案为:否;2Fe3++Cu=2Fe2++Cu2+;Cu2O;KSCN溶液,若溶液变血红色;
(6)2Fe3++Cu=Cu2++2Fe2+,Cu2O+2H+═Cu+Cu2++H2O,固体为铜,铁离子全部反应生成亚铁离子,生成1.0molFe2+,消耗Cu0.5mol,剩余Cu物质的量=$\frac{3.2g}{64g/mol}$=0.05mol,原样品中Cu2O物质的量=0.05mol+0.5mol=0.55mol,
故答案为:0.55.
点评 本题考查了物质组成的分析判断,实验过程分析应用,主要是氧化还原反应发生的条件,产物判断,掌握基础是关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
 人体内的铁是以Fe2+ 和Fe3+的形式存在.正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁.服用维生素C,可使食物中的Fe3+还原成Fe2+,有利于人体吸收.
人体内的铁是以Fe2+ 和Fe3+的形式存在.正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁.服用维生素C,可使食物中的Fe3+还原成Fe2+,有利于人体吸收.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 分别加热Na2CO3和NaHCO3固体 | 试管内壁均有水珠 | 两种物质均受热分解 |
| B | 加热盛有NH4Cl固体的试管 | 试管底部固体消失,试管口有晶体凝结 | NH4Cl固体可以升华 |
| C | 向NaBr溶液中滴入少量氯水和苯,振荡、静置 | 溶液上层呈橙红色 | Br-还原性强于Cl- |
| D | 向FeSO4溶液中先滴入KSCN溶液,再滴加H2O2溶液 | 加入H2O2后溶液变成血红色 | Fe2+既有氧化性又有还原性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
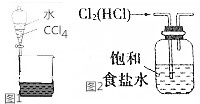 下列关于物质的分离提纯不正确的是( )
下列关于物质的分离提纯不正确的是( )| A. | 用如图1所示装置分离CCl4和水 | |
| B. | 除去苯中的少量苯酚,加入适量浓溴水,过滤 | |
| C. | 实验室用如图2所示装置除去Cl2中的少量HCl | |
| D. | 除去O2中混有得得少量SO2,可将混合气体依次通过盛有酸性KMnO4溶液、浓硫酸的洗气瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验 序号 | 碳酸钙 状态 | c(HCl) /mol•L-1 | 溶液温度/℃ | 碳酸钙消失 时间/s | |
| 反应前 | 反应后 | ||||
| 1 | 粒状 | 0.5 | 20 | 39 | 400 |
| 2 | 粉末 | 0.5 | 20 | 40 | 60 |
| 3 | 粒状 | 0.6 | 20 | 41 | 280 |
| 4 | 粒状 | 0.8 | 20 | 40 | 200 |
| 5 | 粉末 | 0.8 | 20 | 40 | 30 |
| 6 | 粒状 | 1.0 | 20 | 40 | 120 |
| 7 | 粒状 | 1.0 | 30 | 50 | 40 |
| 8 | 粒状 | 1.2 | 20 | 40 | 90 |
| 9 | 粒状 | 1.2 | 25 | 45 | 40 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取.纯净的A为无色黏稠液体,易溶于水.为研究A的组成与结构,进行了如下实验:
有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取.纯净的A为无色黏稠液体,易溶于水.为研究A的组成与结构,进行了如下实验: .
. $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$ +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
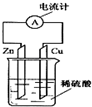 如图所示,把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池.下列叙述正确的是( )
如图所示,把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池.下列叙述正确的是( )| A. | 该装置将电能转变为化学能 | B. | 电流从锌片经导线流向铜片 | ||
| C. | 一段时间后,铜片质量减轻 | D. | 锌片上发生氧化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com